Simbolo de Punto de Lewis: Guía Completa para Entender su Importancia en la Química
¿Qué son los Puntos de Lewis y por qué son cruciales?
¿Alguna vez te has preguntado cómo los átomos se unen entre sí para formar las moléculas que componen todo lo que vemos a nuestro alrededor? La química puede parecer un laberinto complicado de reacciones y fórmulas, pero hay herramientas que nos ayudan a desentrañar este misterio. Una de estas herramientas es el símbolo de punto de Lewis, una representación gráfica que nos permite visualizar la estructura electrónica de los átomos y cómo se unen para formar compuestos. En este artículo, te guiaré a través de todo lo que necesitas saber sobre los puntos de Lewis, desde su origen hasta su aplicación en la química moderna.
Los puntos de Lewis son más que simples dibujitos; son una ventana al mundo de la química. Imagínate que estás armando un rompecabezas: cada pieza (o átomo) tiene sus características y forma única, pero solo encajando de la manera correcta puedes completar la imagen. Los puntos de Lewis muestran los electrones de valencia, que son los que se involucran en la formación de enlaces químicos. Así que, si quieres entender cómo se forman las moléculas, los puntos de Lewis son el primer paso para convertirte en un maestro de la química. Pero, ¿cómo funcionan exactamente? Vamos a desglosarlo.
¿Qué es el símbolo de punto de Lewis?
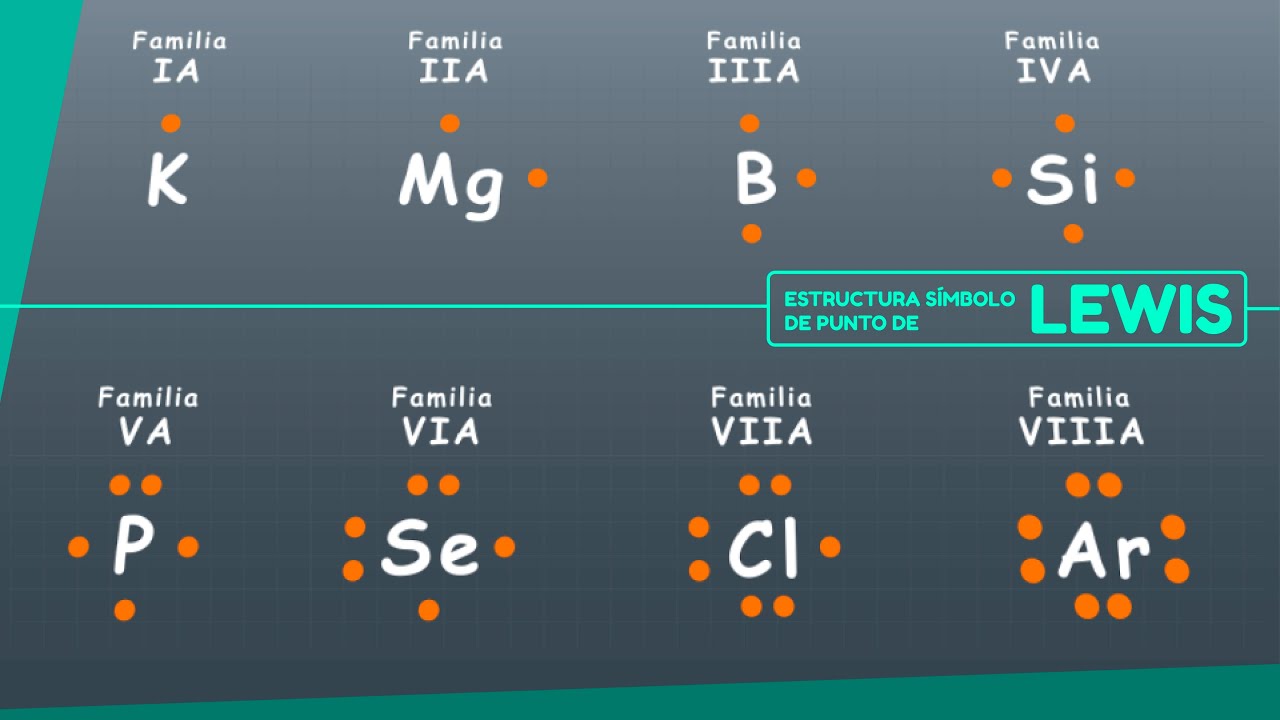
El símbolo de punto de Lewis es una representación gráfica que muestra los electrones de valencia de un átomo. Cada átomo se representa con su símbolo químico, y los electrones de valencia se indican como puntos alrededor de este símbolo. Por ejemplo, el átomo de oxígeno se representa como «O» y, si tiene seis electrones de valencia, se dibujaría con seis puntos alrededor de la letra. Esta visualización es esencial porque los electrones de valencia son los que participan en la formación de enlaces químicos.
Historia y desarrollo
La idea de los puntos de Lewis fue desarrollada por el químico estadounidense Gilbert N. Lewis en 1916. Su objetivo era proporcionar una forma más sencilla de entender cómo los átomos se unen para formar moléculas. Antes de esto, los científicos ya tenían algunas nociones sobre enlaces químicos, pero no había un método tan visual y accesible. La introducción de los puntos de Lewis revolucionó la forma en que los estudiantes y científicos piensan sobre la química. ¡Imagina cómo sería aprender química sin esta herramienta tan útil!
¿Cómo se dibujan los puntos de Lewis?
Dibujar un símbolo de punto de Lewis puede parecer complicado al principio, pero en realidad es bastante sencillo. Aquí tienes un paso a paso:
1. Identifica el elemento: Comienza por identificar el elemento químico del que estás trabajando. Necesitas saber cuántos electrones de valencia tiene. Puedes encontrar esta información en la tabla periódica. Por ejemplo, el carbono tiene cuatro electrones de valencia.
2. Escribe el símbolo del elemento: Coloca el símbolo químico en el centro. Para el carbono, escribirías «C».
3. Dibuja los puntos: Ahora, dibuja los puntos alrededor del símbolo. Cada punto representa un electrón de valencia. Los puntos se colocan en los cuatro lados del símbolo (arriba, abajo, izquierda y derecha) y se emparejan en caso de que haya electrones de valencia adicionales.
4. Asegúrate de la correcta distribución: Los electrones deben distribuirse de manera que sigan la regla del octeto, que dice que los átomos tienden a tener ocho electrones en su capa más externa. Esto es especialmente importante para los elementos en los periodos más altos de la tabla periódica.
Ejemplo práctico
Supongamos que queremos dibujar el símbolo de Lewis para el agua (H₂O). Comenzamos con el oxígeno, que tiene seis electrones de valencia. Escribimos «O» y dibujamos seis puntos alrededor de él. Luego, añadimos los dos átomos de hidrógeno, cada uno con un electrón de valencia. Al final, conectamos los electrones de hidrógeno al oxígeno para mostrar cómo se forman los enlaces.
Tipos de enlaces químicos
Los puntos de Lewis también nos ayudan a entender los diferentes tipos de enlaces químicos: covalentes, iónicos y metálicos.
Enlaces covalentes
Los enlaces covalentes se forman cuando dos átomos comparten electrones. Imagina que dos amigos se pasan una bolsa de dulces: ambos comparten y disfrutan. En el caso del agua, el oxígeno comparte electrones con los átomos de hidrógeno, creando un enlace covalente. Los puntos de Lewis son perfectos para visualizar este tipo de enlace, ya que podemos ver cómo los electrones se comparten.
Enlaces iónicos
Los enlaces iónicos, por otro lado, son como una relación en la que uno de los amigos da todos los dulces a otro. En este tipo de enlace, un átomo cede uno o más electrones a otro átomo, creando cargas opuestas que se atraen entre sí. Por ejemplo, en el cloruro de sodio (NaCl), el sodio cede un electrón al cloro. Los puntos de Lewis nos permiten visualizar cómo se transfieren los electrones entre los átomos.
Enlaces metálicos
Los enlaces metálicos son un poco diferentes. Imagina una gran fiesta donde todos los amigos están bailando y compartiendo dulces al mismo tiempo. En este caso, los electrones de valencia se mueven libremente entre los átomos de metal, creando una «nube» de electrones. Esto explica por qué los metales son buenos conductores de electricidad. Los puntos de Lewis pueden ser un poco menos útiles para representar enlaces metálicos, pero aún así nos dan una idea de cómo funcionan.
Aplicaciones de los símbolos de Lewis
Ahora que sabemos qué son y cómo se dibujan los puntos de Lewis, es hora de hablar sobre su importancia en la química. Estas representaciones son fundamentales en varias áreas:
Química orgánica
En la química orgánica, los puntos de Lewis son esenciales para entender la estructura de compuestos más complejos, como los hidrocarburos. Por ejemplo, al estudiar el etano (C₂H₆), podemos usar los puntos de Lewis para visualizar cómo los átomos de carbono se unen entre sí y con los átomos de hidrógeno. Esto nos ayuda a predecir las propiedades químicas y físicas de los compuestos.
Predicción de reacciones químicas
Los puntos de Lewis también son útiles para predecir cómo se comportarán las moléculas en una reacción química. Al comprender la estructura de los reactivos, podemos anticipar los productos que se formarán. Por ejemplo, al estudiar la reacción entre el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH), los puntos de Lewis nos permiten visualizar cómo se intercambian electrones y se forman nuevos enlaces.
Educación química
En el ámbito educativo, los puntos de Lewis son una herramienta invaluable. Facilitan la enseñanza de conceptos complejos de manera visual y accesible. Los estudiantes pueden aprender a dibujar los puntos de Lewis y a utilizar esta representación para resolver problemas de química. Además, fomenta un enfoque más intuitivo hacia la química, lo que puede aumentar el interés de los estudiantes en la materia.
Limitaciones de los símbolos de Lewis
Aunque los puntos de Lewis son una herramienta útil, también tienen sus limitaciones.
Modelos simplificados
Los puntos de Lewis simplifican la realidad de las interacciones atómicas. No siempre representan con precisión la geometría molecular o los efectos de la resonancia. Por ejemplo, en el caso del benceno, un compuesto que tiene enlaces dobles y simples alternados, el modelo de Lewis no captura la verdadera naturaleza del enlace.
Interacciones más complejas
Además, los puntos de Lewis no son útiles para describir interacciones más complejas, como las fuerzas de Van der Waals o los enlaces de hidrógeno. Estas interacciones son cruciales para entender la química biológica y la química de materiales, pero requieren modelos más avanzados.
Conclusión
Los símbolos de punto de Lewis son una herramienta fundamental en la química que nos permite visualizar la estructura electrónica de los átomos y cómo se unen para formar moléculas. Aunque tienen sus limitaciones, su capacidad para simplificar conceptos complejos los convierte en una herramienta invaluable tanto en la educación como en la investigación química. Así que, la próxima vez que te encuentres con un rompecabezas químico, recuerda que los puntos de Lewis pueden ser tu mejor aliado para desentrañar sus secretos.
Preguntas Frecuentes
1. ¿Puedo usar los puntos de Lewis para cualquier elemento?
Sí, los puntos de Lewis se pueden usar para representar cualquier elemento, aunque son más útiles para aquellos que forman enlaces covalentes, como los no metales.
2. ¿Qué pasa si un átomo tiene más de ocho electrones en su capa de valencia?
En algunos casos, como en los elementos de transición, se puede observar que los átomos tienen más de ocho electrones en su capa de valencia. Esto se debe a la existencia de orbitales d y f, y se requiere un modelo más complejo para describir sus interacciones.
3. ¿Cómo afectan los puntos de Lewis a la química orgánica?
Los puntos de Lewis son esenciales en la química orgánica porque ayudan a visualizar la estructura de compuestos y a predecir su reactividad, lo que es fundamental para la síntesis de nuevos compuestos.
4. ¿Qué herramientas puedo usar además de los puntos de Lewis para estudiar química?
Además de los puntos de Lewis, puedes usar modelos moleculares, diagramas de orbitales y simulaciones por computadora para obtener una comprensión más profunda de la química y las interacciones moleculares.
5. ¿Por qué es importante aprender sobre los puntos de Lewis en la escuela?
Aprender sobre los puntos de Lewis es crucial porque proporciona una base sólida para entender conceptos más avanzados en química, fomenta el pensamiento crítico y ayuda a desarrollar habilidades para resolver problemas.