¿Quién Propuso el Modelo Atómico Actual? Descubre su Historia y Fundamentación
Un Viaje a Través del Tiempo: La Evolución del Modelo Atómico
¡Hola! Hoy te invito a un viaje fascinante a través de la historia del modelo atómico, un concepto que ha evolucionado a lo largo de los siglos. ¿Te has preguntado alguna vez cómo llegamos a entender que todo lo que nos rodea está compuesto de pequeñas partículas llamadas átomos? La historia de este descubrimiento es rica y está llena de personajes intrigantes, teorías revolucionarias y, por supuesto, un poco de drama. Así que, siéntate y prepárate para explorar cómo se ha desarrollado nuestra comprensión del átomo y quiénes fueron las mentes brillantes detrás de este modelo que hoy conocemos.
Los Primeros Pasos: Demócrito y la Idea de lo Indivisible
Todo comenzó hace más de 2400 años con un filósofo griego llamado Demócrito. Imagina a un hombre con una larga barba y una mente curiosa, que se atrevió a sugerir que la materia estaba compuesta por partículas pequeñas e indivisibles que él llamó «átomos». Aunque su idea era más filosófica que científica, fue un primer paso crucial. ¿Quién diría que un simple pensamiento podría marcar el inicio de una revolución en la ciencia?
Demócrito no tenía la tecnología ni los métodos experimentales que tenemos hoy, pero su visión sentó las bases para lo que vendría después. Sin embargo, su teoría fue olvidada durante siglos, ya que la mayoría de los filósofos posteriores, como Aristóteles, rechazaron la idea de que los átomos existían. ¿Te imaginas cómo se sentiría Demócrito al saber que su idea estaba en la cuerda floja durante tanto tiempo?
La Resurrección del Átomo: John Dalton y la Teoría Atómica Moderna
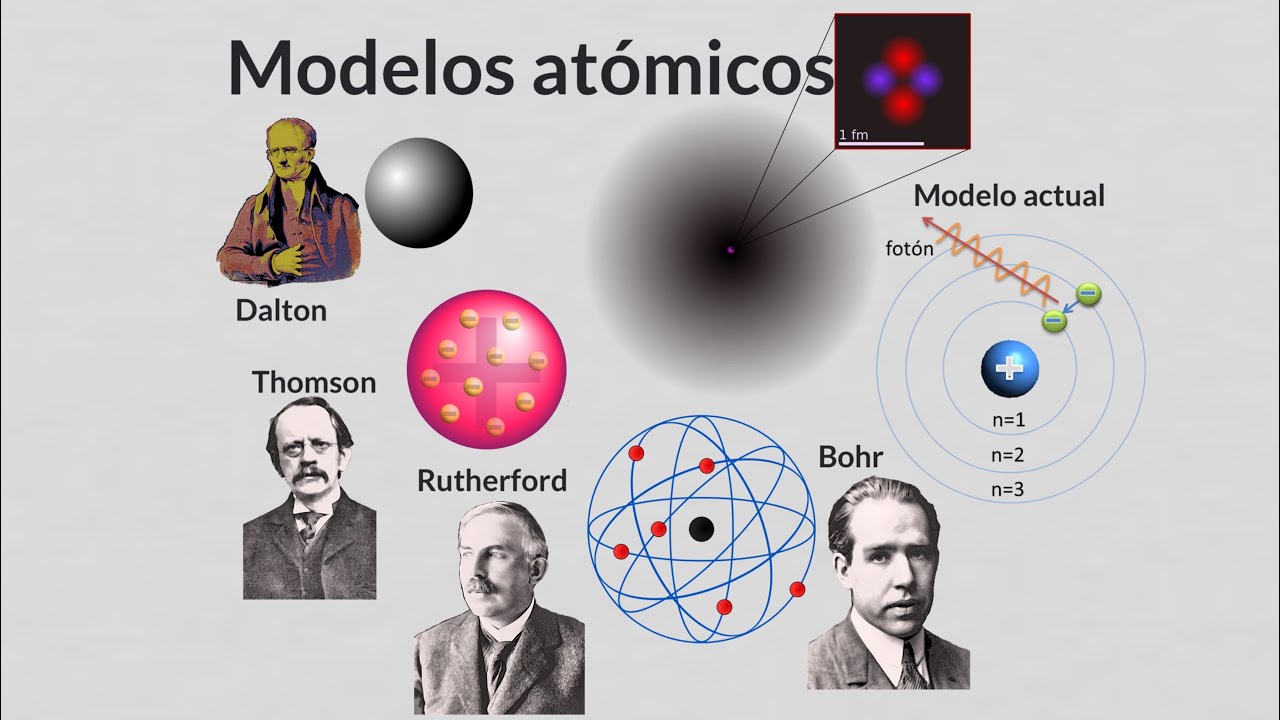
Avancemos unos 2000 años y llegamos a John Dalton, un químico inglés que, a principios del siglo XIX, resucitó la idea del átomo. Con una mente analítica y un enfoque experimental, Dalton propuso que los átomos eran la base de la química. Él formuló una serie de postulados que describían cómo los átomos se combinan para formar compuestos. Imagina que cada átomo es como una pieza de un rompecabezas, encajando perfectamente con otras piezas para crear una imagen más grande.
Dalton no solo revivió la idea del átomo, sino que también le dio un nuevo significado. Su teoría fue el primer intento sistemático de describir la materia en términos atómicos. Sin embargo, su visión era bastante limitada, ya que no conocía la existencia de electrones, protones o neutrones. Pero, ¿quién podría culparlo? En su época, la ciencia estaba dando sus primeros pasos.
Un Mundo de Electrones: J.J. Thomson y el Modelo de Pudín
Pasemos a finales del siglo XIX, donde encontramos a J.J. Thomson, un físico británico que hizo un descubrimiento sorprendente: los electrones. Thomson realizó experimentos con tubos de rayos catódicos y se dio cuenta de que había partículas más pequeñas que el átomo. ¡Eureka! Esto cambió todo. Thomson propuso un nuevo modelo atómico, conocido como el modelo de «pudín de pasas», donde los electrones estaban incrustados en una esfera de carga positiva, como las pasas en un pudín. ¿Te imaginas un postre lleno de pequeñas sorpresas? Así era su modelo.
Sin embargo, este modelo también tenía sus limitaciones. Aunque fue un avance significativo, no explicaba cómo los átomos podían ser estables si tenían cargas positivas y negativas en el mismo lugar. Pero, ¿quién no ama un buen misterio? Thomson había abierto la puerta a más preguntas y descubrimientos.
El Descubrimiento del Núcleo: Ernest Rutherford y el Modelo Planetario
La historia continúa con Ernest Rutherford, quien, a principios del siglo XX, realizó un experimento que cambiaría nuestra visión del átomo para siempre. Al bombardear una delgada lámina de oro con partículas alfa, descubrió que la mayoría de las partículas pasaban a través de la lámina, pero algunas se desviaban. ¿Qué significaba esto? Rutherford propuso que el átomo tenía un núcleo pequeño y denso, cargado positivamente, rodeado por electrones que orbitaban a su alrededor, como planetas alrededor del sol. ¡Qué imagen tan poderosa!
Este modelo planetario fue un gran avance, pero también planteó nuevas preguntas. Si los electrones estaban girando alrededor del núcleo, ¿no deberían perder energía y caer en él? Este enigma llevó a la siguiente gran figura en la historia del modelo atómico.
La Cuantización de la Energía: Niels Bohr y su Revolución
Entra Niels Bohr, un físico danés que tomó las ideas de Rutherford y las llevó a un nuevo nivel. Bohr propuso que los electrones solo podían ocupar ciertas órbitas específicas alrededor del núcleo, y que no perdían energía mientras permanecían en esas órbitas. Este concepto de «niveles de energía cuantizados» fue revolucionario. Imagina que los electrones están en un club exclusivo donde solo pueden entrar si cumplen con ciertas reglas. ¡Eso es lo que Bohr estaba sugiriendo!
El modelo de Bohr fue un gran avance y ayudó a explicar la estructura de los átomos de hidrógeno, pero aún no era perfecto. Con el tiempo, los científicos comenzaron a darse cuenta de que el comportamiento de los electrones era más complejo de lo que Bohr había imaginado.
La Mecánica Cuántica y el Modelo Atómico Moderno
Finalmente, llegamos a la revolución de la mecánica cuántica en el siglo XX, donde mentes brillantes como Werner Heisenberg y Erwin Schrödinger llevaron el modelo atómico a nuevas alturas. La mecánica cuántica introdujo la idea de que no podíamos conocer con certeza la posición y la velocidad de un electrón al mismo tiempo. En lugar de visualizar electrones como partículas en órbitas fijas, comenzaron a ser descritos como «nubes de probabilidad». Esto significa que no se puede decir exactamente dónde está un electrón, solo dónde es probable que esté. ¡Es como buscar un gato en una caja cerrada! Nunca sabes si realmente está ahí o no.
Este nuevo enfoque permitió a los científicos entender mejor la naturaleza del átomo y su comportamiento. La creación del modelo cuántico del átomo fue un hito fundamental que sigue siendo la base de la química moderna. La idea de que los electrones se comportan de manera probabilística y no determinista cambió nuestra forma de ver la realidad.
El Legado del Modelo Atómico Actual
Hoy en día, el modelo atómico que utilizamos es una combinación de todas estas ideas y descubrimientos. Desde los primeros pensamientos de Demócrito hasta la complejidad de la mecánica cuántica, cada uno de estos científicos contribuyó a la construcción de nuestro entendimiento actual. El modelo atómico moderno no solo nos ayuda a entender la materia, sino que también es fundamental en campos como la química, la biología y la física. ¡Es asombroso pensar en cómo una simple idea ha evolucionado tanto!
Reflexiones Finales: ¿Qué Nos Depara el Futuro?
Ahora que hemos recorrido este fascinante viaje, surge la pregunta: ¿qué nos depara el futuro en el estudio del átomo? La ciencia sigue avanzando y, con cada descubrimiento, nos acercamos más a entender los misterios del universo. Tal vez algún día descubramos que los átomos son aún más complejos de lo que pensamos, o que existen dimensiones y partículas que ni siquiera hemos imaginado. La curiosidad humana es insaciable, y eso es lo que impulsa la ciencia hacia adelante.
Preguntas Frecuentes
- ¿Quién fue el primer científico en proponer la existencia de átomos? El primer filósofo en sugerir la existencia de átomos fue Demócrito en la antigua Grecia.
- ¿Qué descubrió J.J. Thomson? J.J. Thomson descubrió los electrones y propuso el modelo de «pudín de pasas» para describir la estructura del átomo.
- ¿Cuál es la diferencia entre el modelo de Bohr y el modelo cuántico? El modelo de Bohr describe los electrones en órbitas fijas, mientras que el modelo cuántico describe a los electrones como nubes de probabilidad.
- ¿Por qué es importante el modelo atómico en la ciencia actual? El modelo atómico es fundamental para entender la química, la biología y la física, y es la base de muchas tecnologías modernas.
- ¿Qué avances futuros podemos esperar en la investigación atómica? La investigación atómica continúa, y es posible que descubramos nuevas partículas o dimensiones que cambien nuestra comprensión del universo.