Modelos Atómicos a lo Largo de la Historia: Evolución y Descubrimientos Clave
Introducción a los Modelos Atómicos
¿Alguna vez te has preguntado qué es un átomo y cómo hemos llegado a entenderlo a lo largo de la historia? La historia de los modelos atómicos es un viaje fascinante que nos lleva desde las ideas filosóficas de la antigua Grecia hasta los descubrimientos más avanzados de la física moderna. A lo largo de los siglos, científicos y pensadores han tratado de desentrañar los misterios de la materia, creando teorías y modelos que han evolucionado con el tiempo. Este artículo te llevará a través de esta evolución, explorando los hitos clave y las mentes brillantes que han dado forma a nuestra comprensión del mundo atómico.
Los Primeros Pensadores: La Antigua Grecia
Todo comenzó en la antigua Grecia, donde filósofos como Demócrito y Epicuro propusieron la idea de que todo está compuesto de pequeñas partículas indivisibles llamadas «átomos». Aunque estas ideas eran más filosóficas que científicas, sentaron las bases para la química moderna. Imagina un mundo donde las cosas se descomponen en piezas más pequeñas, como un rompecabezas que revela su imagen completa solo cuando miras cada pieza individualmente. Sin embargo, la falta de evidencia experimental mantuvo estas ideas en el ámbito de la especulación durante siglos.
Aristóteles y la Cuestión de los Elementos
Luego llegó Aristóteles, quien tenía una visión diferente. Él creía que todo estaba hecho de cuatro elementos: tierra, agua, aire y fuego. Esta idea dominó el pensamiento científico durante más de dos mil años, eclipsando las teorías atomistas. En este punto, el átomo era como un faro en la niebla, una idea brillante que no podía encontrar su camino hacia la luz de la aceptación general. A pesar de que Aristóteles era influyente, sus conceptos erróneos sobre la materia retrasaron el progreso en la comprensión de la estructura atómica.
El Renacimiento y el Surgimiento de la Ciencia Moderna
Con el Renacimiento, la curiosidad y el pensamiento crítico comenzaron a resurgir. La alquimia, aunque estaba llena de supersticiones, sentó las bases para la química moderna. En este período, científicos como Robert Boyle empezaron a experimentar y a cuestionar las ideas tradicionales. Boyle, conocido como el padre de la química moderna, propuso que los elementos eran sustancias puras que no podían descomponerse. ¡Y así, la chispa de la ciencia se encendió de nuevo!
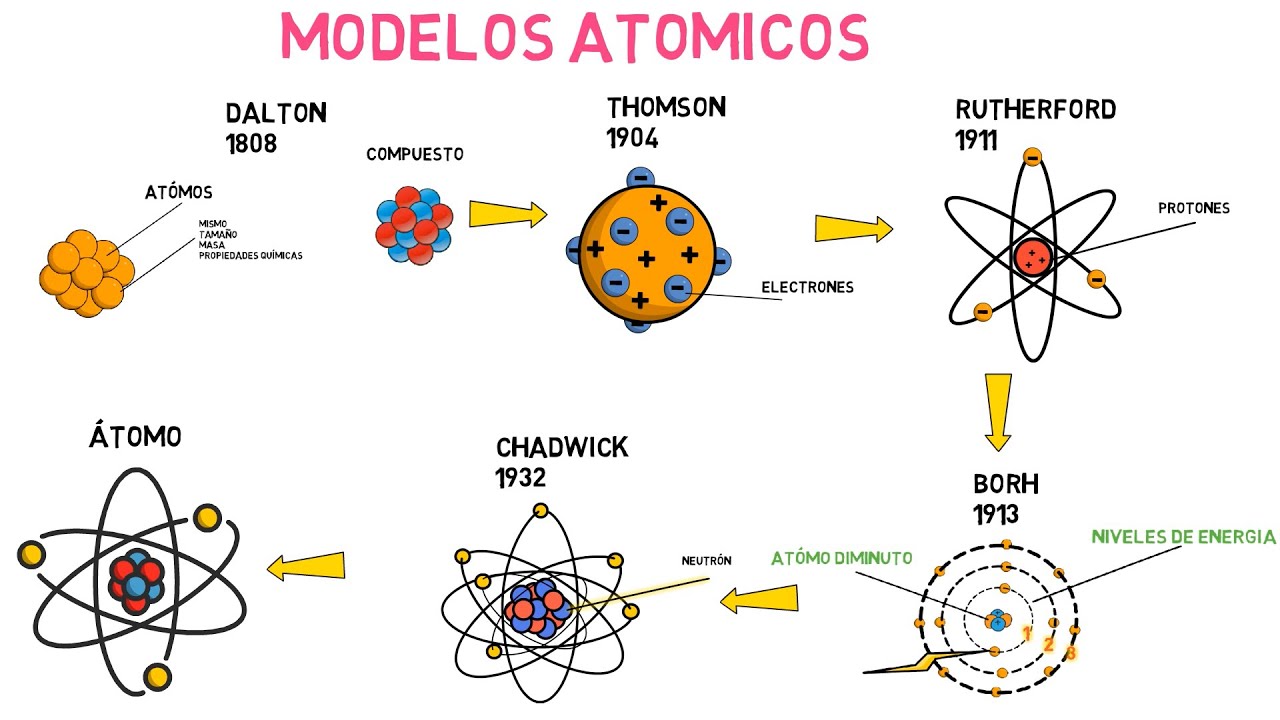
John Dalton y la Teoría Atómica
En el siglo XIX, John Dalton presentó su teoría atómica, que afirmaba que los átomos son esferas indivisibles y que cada elemento tiene un tipo de átomo único. Imagina que cada elemento es como una pieza de Lego: cada uno tiene su forma y color específicos, pero todos pueden unirse para construir algo más grande. Dalton también propuso que los compuestos se forman cuando los átomos de diferentes elementos se combinan en proporciones fijas. Su trabajo fue fundamental y marcó el inicio de la química moderna.
Avances en la Comprensión del Átomo
A medida que la ciencia avanzaba, también lo hacía nuestra comprensión del átomo. En 1897, J.J. Thomson descubrió el electrón, una partícula subatómica que desafió la idea de que el átomo era indivisible. ¡Era como si de repente un nuevo mundo se abriera ante nuestros ojos! Thomson propuso el modelo del «pudín de pasas», donde los electrones estaban incrustados en una esfera positiva. Sin embargo, este modelo pronto sería puesto a prueba.
Ernest Rutherford y el Núcleo Atómico
En 1911, Ernest Rutherford llevó a cabo su famoso experimento de dispersión de partículas alfa, que reveló que los átomos tienen un núcleo denso y positivo. Imagina un pequeño sol en medio de un vasto espacio vacío, donde los electrones orbitan alrededor del núcleo, como planetas girando en el espacio. Este descubrimiento fue un punto de inflexión, y Rutherford propuso un nuevo modelo atómico que reemplazó al de Thomson.
El Modelo de Bohr y la Cuantización de la Energía
En 1913, Niels Bohr presentó su modelo atómico, que introdujo la idea de que los electrones orbitan el núcleo en niveles de energía discretos. Este concepto de cuantización de la energía fue revolucionario. Piensa en un tren que solo puede detenerse en estaciones específicas; los electrones solo pueden existir en ciertos niveles de energía. Este modelo explicaba la estabilidad de los átomos y la emisión de luz en términos de saltos entre estos niveles de energía. ¡La física cuántica estaba en marcha!
La Mecánica Cuántica y el Modelo de Nube Electrónica
Sin embargo, el modelo de Bohr no era suficiente para explicar todos los fenómenos atómicos. A medida que avanzaba el siglo XX, la mecánica cuántica comenzó a tomar forma. Científicos como Werner Heisenberg y Erwin Schrödinger propusieron que no se podía conocer con precisión la posición y la velocidad de un electrón al mismo tiempo. En lugar de trayectorias definidas, los electrones se describen como «nubes» de probabilidad. Imagina un enjambre de abejas, donde no puedes predecir exactamente dónde estará cada abeja, pero puedes estimar dónde es más probable que se encuentren.
Aplicaciones Modernas de la Teoría Atómica
Hoy en día, el modelo atómico sigue evolucionando. La teoría cuántica ha permitido avances tecnológicos que transforman nuestra vida cotidiana, desde la computación cuántica hasta la medicina nuclear. Pero, ¿qué significa esto para nosotros? Significa que hemos pasado de ideas filosóficas a una comprensión profunda y técnica del mundo que nos rodea. ¡Es un viaje asombroso!
Impacto en la Tecnología y la Industria
La comprensión del átomo ha tenido un impacto monumental en la tecnología. Por ejemplo, la energía nuclear, que se basa en la fisión de los núcleos atómicos, ha proporcionado una fuente de energía potente pero también plantea desafíos éticos y de seguridad. Además, la nanotecnología, que manipula átomos y moléculas, está revolucionando campos como la medicina y la electrónica. ¡El futuro es brillante y lleno de posibilidades!
Reflexiones Finales sobre el Átomo
La historia de los modelos atómicos es un recordatorio de cómo la curiosidad humana puede desentrañar los secretos del universo. Desde los antiguos filósofos griegos hasta los físicos cuánticos de hoy, cada descubrimiento ha sido un paso hacia la comprensión de la materia y la energía. Y lo más emocionante es que todavía hay mucho por descubrir. ¿Quién sabe qué nuevos modelos y teorías surgirán en el futuro?
Preguntas Frecuentes
- ¿Qué es un átomo? Un átomo es la unidad básica de la materia, compuesta por un núcleo central que contiene protones y neutrones, rodeado por electrones que orbitan alrededor de él.
- ¿Cuáles son los principales modelos atómicos? Los modelos atómicos más importantes incluyen el modelo de Dalton, el modelo de Thomson, el modelo de Rutherford y el modelo de Bohr, seguido por la mecánica cuántica que describe la nube electrónica.
- ¿Cómo ha cambiado nuestra comprensión del átomo a lo largo del tiempo? Inicialmente, los átomos se pensaban como indivisibles, pero a medida que avanzó la ciencia, se descubrieron partículas subatómicas y se desarrollaron teorías más complejas sobre la estructura atómica.
- ¿Por qué es importante el estudio de la química y los modelos atómicos? La química y los modelos atómicos son fundamentales para entender la materia, los compuestos y las reacciones químicas, lo que tiene aplicaciones en la medicina, la industria y la tecnología.
- ¿Qué avances tecnológicos han surgido de la teoría atómica? La teoría atómica ha llevado a desarrollos en energía nuclear, nanotecnología, medicina nuclear y muchas otras áreas que impactan nuestras vidas diarias.