Modelo del Átomo Cúbico de Lewis: Todo lo que Necesitas Saber
Introducción al Modelo del Átomo Cúbico de Lewis
¿Alguna vez te has preguntado cómo se forman las moléculas en nuestro mundo? El modelo del átomo cúbico de Lewis es una herramienta fascinante que nos ayuda a visualizar la estructura de los átomos y cómo interactúan entre sí. A través de este modelo, podemos entender mejor la química detrás de las sustancias que nos rodean. Desde el agua que bebemos hasta el aire que respiramos, todo está compuesto de átomos que se organizan de maneras increíbles. Pero, ¿qué es exactamente este modelo y cómo se aplica en la práctica? En este artículo, desglosaremos el modelo cúbico de Lewis, explorando su origen, características y aplicaciones, todo mientras mantenemos una conversación amena y accesible.
Para empezar, el modelo cúbico de Lewis se basa en la representación de los electrones de valencia en los átomos. Lewis, un químico estadounidense, propuso que los electrones se pueden representar como puntos alrededor del símbolo del elemento. Esto nos permite visualizar fácilmente cómo los átomos se combinan para formar moléculas. Imagina que los electrones son como los invitados en una fiesta: algunos están dispuestos a compartir su espacio y otros prefieren mantenerse en su rincón. Esta analogía nos ayuda a comprender la dinámica de las interacciones atómicas. Pero, ¿cómo se aplica esto en la práctica? Vamos a profundizar en los detalles.
Historia y Orígenes del Modelo de Lewis
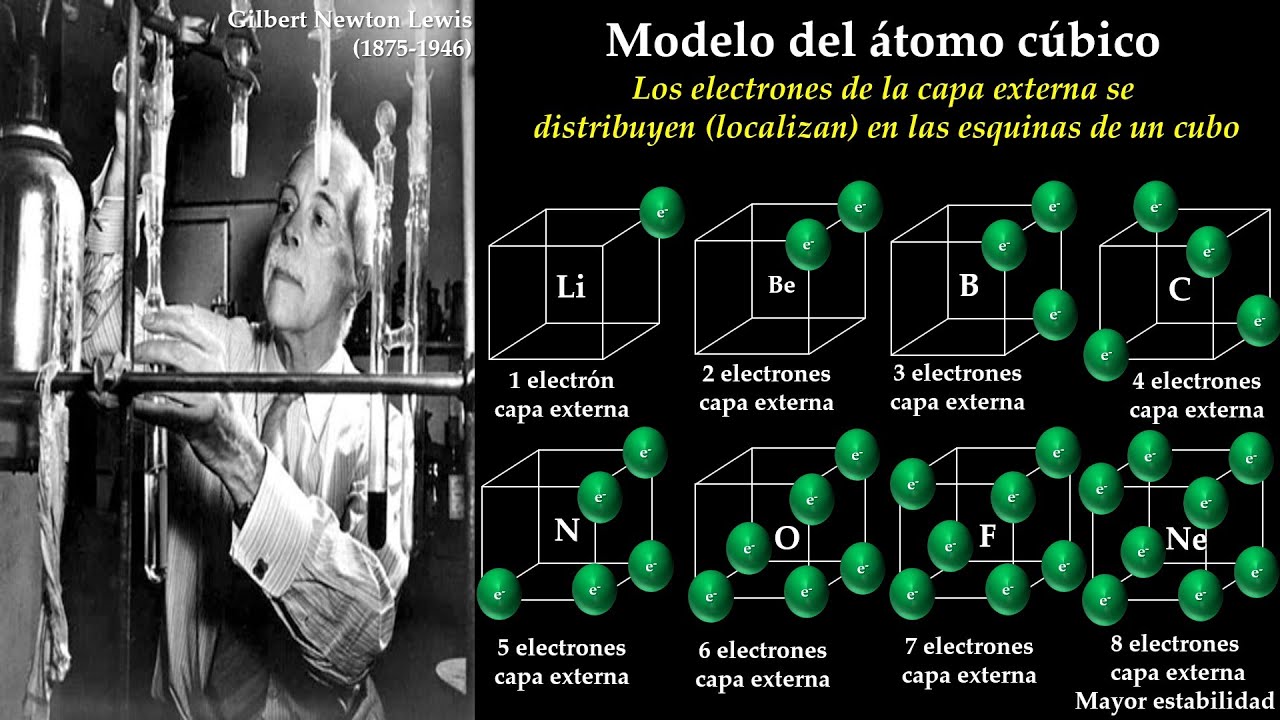
El modelo de Lewis tiene sus raíces en la búsqueda de una mejor comprensión de la estructura atómica a principios del siglo XX. Gilbert N. Lewis, un pionero en la química, propuso su teoría en 1916. Su idea fue revolucionaria, ya que cambió la forma en que los científicos pensaban sobre la formación de enlaces químicos. Antes de Lewis, la química se basaba en modelos más simples que no podían explicar todas las interacciones entre los átomos. Al introducir el concepto de electrones de valencia, Lewis abrió la puerta a una nueva era de comprensión química.
Pero, ¿qué hizo que su modelo fuera tan especial? A diferencia de otros modelos, el de Lewis se centra en la importancia de los electrones en la capa externa del átomo. Estos electrones son los responsables de la formación de enlaces y, por lo tanto, son cruciales para la estabilidad de las moléculas. Lewis utilizó puntos para representar estos electrones, lo que facilitó la visualización de cómo los átomos se unen. A partir de ahí, su modelo se expandió y se incorporó a la enseñanza de la química en todo el mundo.
Características del Modelo del Átomo Cúbico de Lewis
El modelo del átomo cúbico de Lewis se basa en varios principios clave que son esenciales para entender cómo funciona. Primero, hablemos de los electrones de valencia. Cada elemento tiene un número específico de electrones en su capa externa, y este número determina cómo se comporta en reacciones químicas. Por ejemplo, el sodio tiene un electrón de valencia, mientras que el cloro tiene siete. Esto significa que el sodio está dispuesto a perder su electrón para formar un enlace, mientras que el cloro busca ganar uno. ¡Es como un juego de atracción!
Además, el modelo de Lewis también nos ayuda a comprender los tipos de enlaces que se forman entre los átomos. Existen enlaces covalentes, donde los átomos comparten electrones, y enlaces iónicos, donde un átomo dona electrones a otro. Esta distinción es fundamental para entender la química de diferentes compuestos. Imagina que los átomos son como personas en una relación: algunos prefieren compartir su tiempo (electrones) mientras que otros están más interesados en recibirlo.
Representación de los Electronos de Valencia
Una de las características más interesantes del modelo de Lewis es su representación gráfica de los electrones de valencia. Usando puntos alrededor del símbolo del elemento, los químicos pueden visualizar rápidamente la disposición de estos electrones. Por ejemplo, el oxígeno, que tiene seis electrones de valencia, se representaría con seis puntos alrededor de su símbolo. Esta representación no solo es útil para los científicos, sino que también permite a los estudiantes aprender y recordar la estructura de los átomos de manera más efectiva.
Formación de Estructuras Moleculares
Cuando los átomos se combinan, forman estructuras moleculares que pueden ser simples o complejas. Aquí es donde el modelo de Lewis brilla, ya que permite a los químicos predecir la forma en que los átomos se unirán. Por ejemplo, cuando el hidrógeno y el oxígeno se combinan para formar agua, podemos visualizar cómo los electrones de valencia se comparten entre los átomos. Esta representación no solo es útil para la química teórica, sino que también tiene aplicaciones prácticas en la creación de nuevos compuestos en laboratorios.
Aplicaciones Prácticas del Modelo de Lewis
Ahora que hemos cubierto los aspectos fundamentales del modelo cúbico de Lewis, es hora de ver cómo se aplica en el mundo real. Desde la creación de nuevos medicamentos hasta la producción de materiales innovadores, este modelo tiene un impacto significativo en diversas áreas de la ciencia y la tecnología.
Desarrollo de Nuevos Medicamentos
Uno de los campos más importantes donde se utiliza el modelo de Lewis es en la farmacología. Al comprender cómo se forman las moléculas y cómo interactúan entre sí, los científicos pueden diseñar nuevos medicamentos que se dirigen a objetivos específicos en el cuerpo. Por ejemplo, al representar las estructuras moleculares de las proteínas y los fármacos, los investigadores pueden identificar cómo un medicamento puede unirse a su objetivo y, por lo tanto, cómo puede afectar la salud de una persona. Es como encontrar la llave perfecta para abrir una cerradura.
Creación de Materiales Innovadores
Además de la medicina, el modelo de Lewis también juega un papel crucial en la creación de nuevos materiales. Desde plásticos hasta nanomateriales, los químicos utilizan este modelo para predecir cómo se comportarán diferentes combinaciones de átomos. Por ejemplo, al entender la estructura de un polímero, los científicos pueden manipular sus propiedades para que sean más resistentes o flexibles. ¡Es como ser un arquitecto de moléculas!
Desafíos y Limitaciones del Modelo de Lewis
Aunque el modelo de Lewis es increíblemente útil, también tiene sus limitaciones. Uno de los principales desafíos es que no puede explicar completamente la complejidad de ciertos compuestos. Por ejemplo, en moléculas grandes o en sistemas que involucran electrones en diferentes capas, el modelo puede volverse menos preciso. En estos casos, los científicos pueden recurrir a modelos más avanzados, como la teoría del orbital molecular, que ofrece una visión más detallada de cómo se comportan los electrones.
El Futuro del Modelo de Lewis
A pesar de sus limitaciones, el modelo de Lewis sigue siendo una herramienta esencial en la educación y la investigación química. A medida que avanzamos en el campo de la química, es probable que veamos nuevas formas de representar y entender la estructura atómica. Sin embargo, el legado de Lewis perdurará, ya que sentó las bases para la química moderna.
Conclusión: Reflexiones Finales sobre el Modelo de Lewis
En resumen, el modelo del átomo cúbico de Lewis es una herramienta poderosa que nos ayuda a comprender la química de nuestro mundo. Desde su origen hasta sus aplicaciones prácticas, este modelo ha demostrado ser invaluable en la ciencia. Si bien enfrenta desafíos, su impacto en la educación y la investigación química es innegable. Así que la próxima vez que te encuentres con una fórmula química o un compuesto, recuerda que detrás de cada enlace hay una historia fascinante de electrones que buscan su lugar en el universo.
Preguntas Frecuentes
¿Qué es el modelo cúbico de Lewis?
El modelo cúbico de Lewis es una representación gráfica que muestra la disposición de los electrones de valencia en los átomos, ayudando a entender cómo se forman los enlaces químicos.
¿Cuáles son los tipos de enlaces que se pueden formar según el modelo de Lewis?
Según el modelo de Lewis, se pueden formar enlaces covalentes, donde los electrones se comparten, y enlaces iónicos, donde un átomo dona electrones a otro.
¿Por qué es importante el modelo de Lewis en la educación química?
El modelo de Lewis es importante porque proporciona una forma visual y accesible de entender la estructura atómica y las interacciones entre átomos, facilitando el aprendizaje de conceptos químicos complejos.
¿Existen limitaciones en el modelo de Lewis?
Sí, el modelo de Lewis tiene limitaciones, especialmente en moléculas grandes o sistemas complejos, donde puede ser menos preciso. En tales casos, se utilizan modelos más avanzados como la teoría del orbital molecular.
¿Cómo se aplica el modelo de Lewis en el desarrollo de nuevos medicamentos?
El modelo de Lewis ayuda a los científicos a comprender cómo las moléculas interactúan en el cuerpo, permitiendo el diseño de medicamentos que se dirigen a objetivos específicos, mejorando su eficacia y seguridad.
Este artículo proporciona una visión general del modelo del átomo cúbico de Lewis, su historia, características, aplicaciones y algunas limitaciones. Espero que te resulte útil y atractivo.