Modelo Atómico de Bohr del Nitrógeno: Estructura y Características Clave
Introducción al Modelo Atómico de Bohr
El modelo atómico de Bohr, propuesto por el físico danés Niels Bohr en 1913, revolucionó nuestra comprensión sobre la estructura del átomo. Imagina que el átomo es como un pequeño sistema solar, donde los electrones giran alrededor del núcleo como los planetas orbitan alrededor del sol. Este modelo fue especialmente significativo para entender átomos simples como el hidrógeno, pero también se puede aplicar a elementos más complejos como el nitrógeno. En este artículo, nos adentraremos en la estructura del nitrógeno a través de la lente del modelo de Bohr, explorando sus características clave y su relevancia en el mundo de la química.
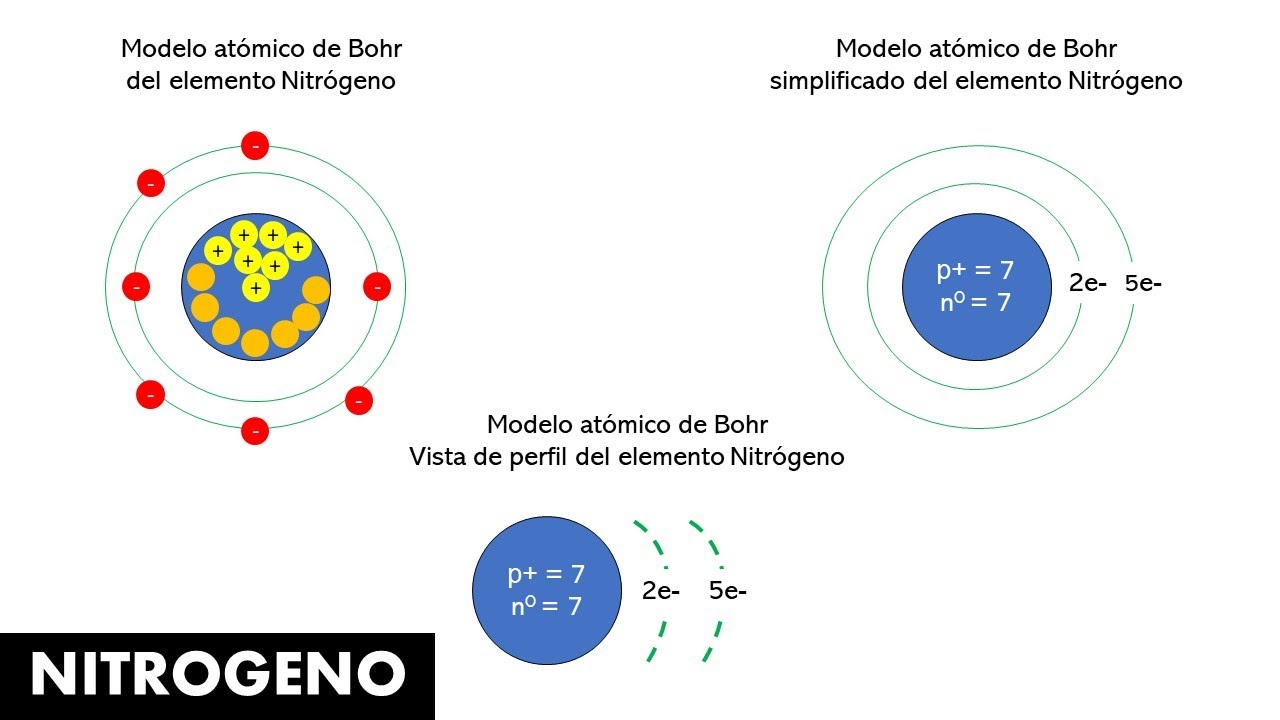
El nitrógeno, con el símbolo químico N y un número atómico de 7, es un elemento fundamental en la naturaleza. Se encuentra en la atmósfera en una proporción del 78%, y es esencial para la vida, ya que forma parte de aminoácidos y ácidos nucleicos. Pero, ¿cómo se organiza este elemento a nivel atómico? A continuación, desglosaremos el modelo atómico de Bohr en relación al nitrógeno, comenzando por su configuración electrónica.
Configuración Electrónica del Nitrógeno
La configuración electrónica es como la dirección que sigue un mapa para entender cómo están dispuestos los electrones en un átomo. Para el nitrógeno, la configuración electrónica es 1s² 2s² 2p³. Esto significa que en el primer nivel de energía, que es el 1s, hay dos electrones, y en el segundo nivel, que abarca 2s y 2p, hay cinco electrones en total.
Primer Nivel de Energía: 1s
En el primer nivel de energía, solo hay espacio para dos electrones. Estos electrones son como los pilares fundamentales del átomo, proporcionando estabilidad y una base sólida. En nuestro modelo solar, podríamos pensar en ellos como el sol mismo, el núcleo de la estructura.
Segundo Nivel de Energía: 2s y 2p
El segundo nivel de energía es donde la cosa se vuelve más interesante. Aquí es donde encontramos los electrones 2s y 2p. El 2s tiene espacio para otros dos electrones, pero luego tenemos tres electrones en el subnivel 2p. Esto es crucial, ya que estos electrones son los que participan en las reacciones químicas, formando enlaces con otros átomos. Así que, si pensáramos en el sistema solar, estos electrones serían como los planetas más distantes, moviéndose en órbitas más amplias y generando una mayor interacción con otros sistemas solares (es decir, otros átomos).
Características Clave del Modelo de Bohr
El modelo de Bohr se basa en varios postulados que ayudan a entender cómo se comportan los electrones. Vamos a desglosar estos postulados para ver cómo se aplican al nitrógeno.
Órbitas Estacionarias
Una de las ideas más importantes del modelo de Bohr es que los electrones se mueven en órbitas estacionarias alrededor del núcleo. Esto significa que los electrones no pueden estar en cualquier lugar, sino que solo pueden ocupar ciertos niveles de energía específicos. En el caso del nitrógeno, esto se traduce en que los electrones 2s y 2p ocupan órbitas específicas que les permiten mantener su energía sin emitir radiación.
Cuantización de la Energía
Bohr propuso que la energía de un electrón en una órbita específica es cuantizada, lo que significa que solo puede tener ciertos valores discretos. Esto es similar a un juego de escaleras: solo puedes estar en ciertos escalones, no en cualquier lugar entre ellos. Por lo tanto, cuando un electrón gana o pierde energía, salta de una órbita a otra, lo que puede resultar en la emisión o absorción de luz. En el nitrógeno, este fenómeno es fundamental para entender cómo interactúa con la luz y cómo se producen ciertos colores en sus compuestos.
Interacciones Químicas del Nitrógeno
Ahora que hemos establecido cómo se organiza el nitrógeno a nivel atómico, es hora de ver cómo estas características influyen en su comportamiento químico. El nitrógeno es conocido por formar compuestos estables, como el amoníaco (NH₃) y los nitratos (NO₃⁻). Pero, ¿qué lo hace tan especial?
Formación de Enlaces Covalentes
El nitrógeno tiene una tendencia a compartir electrones con otros átomos, formando enlaces covalentes. Esto ocurre porque, con sus cinco electrones en la capa externa, necesita tres electrones más para completar su octeto y alcanzar la estabilidad. Esta búsqueda de estabilidad es como una persona que busca completar un rompecabezas: el nitrógeno necesita encajar las piezas de electrones de otros átomos para lograrlo.
La Triple Enlace en el Nitrógeno Molecular
Una de las características más fascinantes del nitrógeno es su capacidad para formar un triple enlace con otro átomo de nitrógeno, creando la molécula N₂. Este enlace es increíblemente fuerte y requiere mucha energía para romperse. Este es un gran ejemplo de cómo el modelo de Bohr y la configuración electrónica del nitrógeno influyen en su química. La fuerza del triple enlace también explica por qué el nitrógeno es tan inerte en su forma molecular; es como una pareja que ha estado junta tanto tiempo que se vuelve difícil separarlos.
Aplicaciones del Nitrógeno en la Industria y la Ciencia
El nitrógeno no solo es fascinante desde una perspectiva química; también tiene numerosas aplicaciones en la industria y la ciencia. Su abundancia y versatilidad lo hacen ideal para una variedad de usos.
Producción de Fertilizantes
Una de las aplicaciones más conocidas del nitrógeno es en la producción de fertilizantes. A través de la fijación del nitrógeno, se puede convertir el nitrógeno atmosférico en formas que las plantas pueden utilizar. Esto es fundamental para la agricultura moderna, ya que permite el crecimiento de cultivos y ayuda a alimentar a la población mundial.
Uso en la Industria Alimentaria
El nitrógeno también se utiliza en la industria alimentaria. ¿Alguna vez has visto un paquete de comida que dice «envasado al vacío»? Eso a menudo implica el uso de nitrógeno. Al reemplazar el aire en el envase con nitrógeno, se prolonga la vida útil de los productos alimenticios, evitando la oxidación y el deterioro. Así que, de alguna manera, el nitrógeno está presente en nuestra vida cotidiana, aunque no siempre lo notemos.
Conclusiones
En resumen, el modelo atómico de Bohr nos ofrece una manera clara y comprensible de visualizar la estructura del nitrógeno y su comportamiento. A través de su configuración electrónica y sus características clave, podemos entender cómo el nitrógeno forma enlaces y participa en reacciones químicas. Desde su papel en la agricultura hasta su uso en la industria alimentaria, el nitrógeno es un elemento esencial que merece nuestra atención.
¿Te has preguntado alguna vez cómo un simple átomo puede tener un impacto tan grande en el mundo que nos rodea? La próxima vez que mires al cielo y veas las nubes, recuerda que el nitrógeno es un componente fundamental de la atmósfera, trabajando en silencio para mantener la vida en nuestro planeta.
Preguntas Frecuentes
¿Por qué el nitrógeno es tan abundante en la atmósfera?
El nitrógeno es el gas más abundante en la atmósfera debido a su estabilidad y la dificultad de romper sus enlaces moleculares. Esto lo convierte en un componente ideal para mantener el equilibrio en la atmósfera terrestre.
¿Qué es la fijación del nitrógeno?
La fijación del nitrógeno es el proceso mediante el cual el nitrógeno atmosférico es convertido en formas utilizables por las plantas, como el amoníaco. Este proceso es vital para la agricultura y la producción de alimentos.
¿Cómo afecta el nitrógeno a la salud humana?
El nitrógeno en sí mismo no es tóxico, pero en ciertas formas, como el óxido nitroso (N₂O), puede tener efectos adversos sobre la salud y el medio ambiente. Es importante manejar adecuadamente los compuestos nitrogenados en la industria y la agricultura.
¿El nitrógeno es importante para la vida?
Sí, el nitrógeno es esencial para la vida, ya que es un componente clave de aminoácidos y ácidos nucleicos, que son fundamentales para la formación de proteínas y el material genético en los organismos.
¿Qué otros elementos están relacionados con el nitrógeno?
El nitrógeno está relacionado con otros elementos como el fósforo y el potasio, que también son esenciales para el crecimiento de las plantas y forman parte de los fertilizantes. Juntos, estos elementos son conocidos como los «macronutrientes» en la agricultura.