Modelo Atómico de Bohr del Sodio: Estructura y Características Explicadas
Introducción al Modelo Atómico de Bohr
¿Alguna vez te has preguntado cómo está construido el átomo de sodio? Este elemento, esencial para la vida y presente en la sal que utilizamos en nuestra cocina, tiene una estructura fascinante. El modelo atómico de Bohr, propuesto por el físico danés Niels Bohr en 1913, ofrece una forma intrigante de entender cómo se organizan los electrones alrededor del núcleo del átomo. En este artículo, desglosaremos la estructura del átomo de sodio y las características que lo hacen único, utilizando el modelo de Bohr como nuestra guía.
¿Qué es el Modelo Atómico de Bohr?
El modelo de Bohr fue un gran avance en la física atómica. Antes de Bohr, la comprensión de los átomos era bastante limitada. La teoría de Rutherford había demostrado que los átomos tienen un núcleo central, pero no explicaba cómo los electrones podían orbitar alrededor de este sin caer en él. Aquí es donde Bohr hizo su magia. Propuso que los electrones se mueven en órbitas definidas y que solo pueden ocupar ciertos niveles de energía. Esto significa que, en lugar de estar en cualquier lugar alrededor del núcleo, los electrones «salen» en estas órbitas específicas, como los planetas girando alrededor del sol.
Características del Modelo de Bohr
Una de las características más interesantes del modelo de Bohr es la idea de los niveles de energía. Cada órbita corresponde a un nivel de energía específico. Cuanto más lejos está un electrón del núcleo, mayor es su energía. Pero, ¿qué sucede si un electrón recibe suficiente energía? Puede saltar a una órbita más alta, un fenómeno conocido como excitación. Sin embargo, este estado no dura para siempre. El electrón eventualmente regresará a su órbita original, liberando energía en forma de luz. Este principio es la base de muchos fenómenos ópticos, como el color de las llamas en los fuegos artificiales.
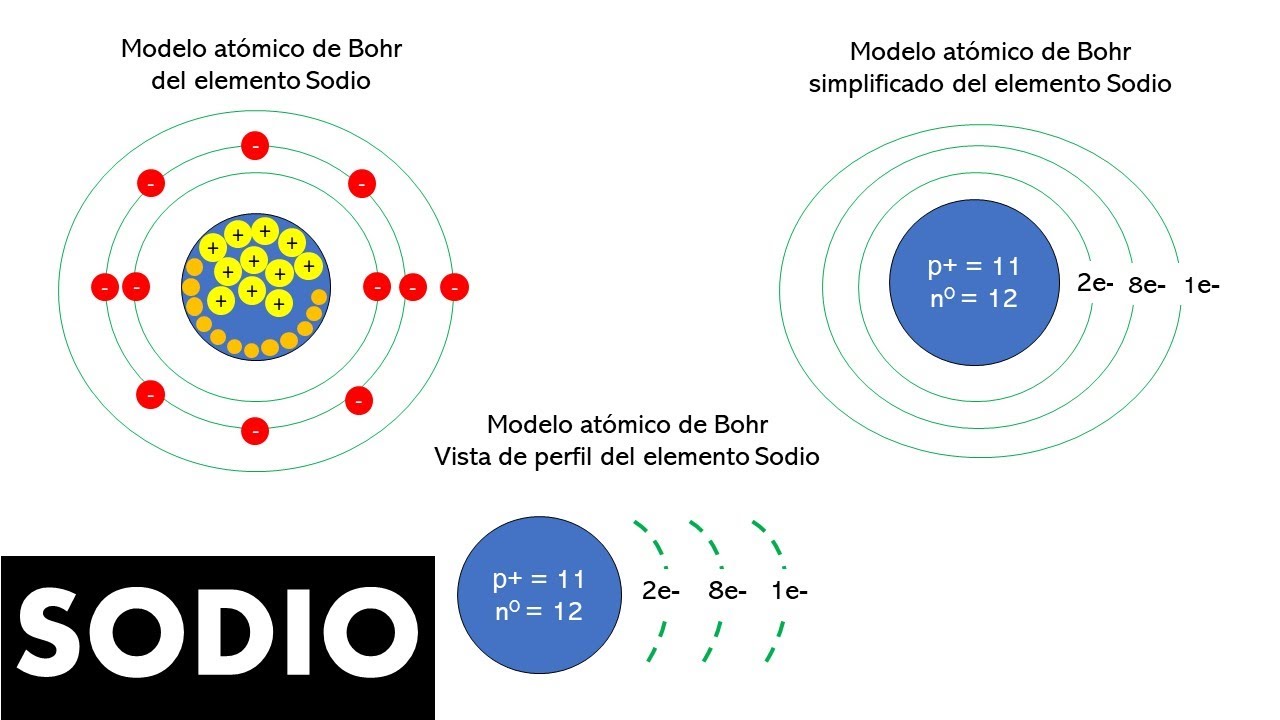
El Átomo de Sodio: Estructura y Composición
El sodio, cuyo símbolo químico es Na, tiene un número atómico de 11. Esto significa que tiene 11 protones en su núcleo. Pero, ¿cuántos electrones tiene? En un átomo neutro de sodio, la cantidad de electrones es igual a la de protones, así que también tiene 11 electrones. En el modelo de Bohr, estos electrones se distribuyen en niveles de energía alrededor del núcleo. El sodio tiene tres niveles de energía, con 2 electrones en el primer nivel, 8 en el segundo y 1 en el tercer nivel. Este único electrón en el tercer nivel es el que juega un papel crucial en la química del sodio.
La Importancia del Electrón Externo
El electrón en el tercer nivel de energía es conocido como un electrón de valencia. Este electrón es fundamental para la reactividad química del sodio. ¿Por qué? Porque los átomos tienden a buscar estabilidad, y el sodio puede alcanzar esa estabilidad al perder este electrón. Al hacerlo, se convierte en un ion positivo (Na+), lo que le permite unirse fácilmente a otros átomos, como el cloro, para formar compuestos como la sal de mesa (NaCl). Este proceso es un ejemplo perfecto de cómo la estructura atómica influye en la química.
¿Por Qué el Modelo de Bohr es Relevante Hoy en Día?
Aunque el modelo de Bohr fue un gran avance en su momento, con el tiempo se han desarrollado teorías más avanzadas que explican la mecánica cuántica de los electrones. Sin embargo, el modelo de Bohr sigue siendo relevante y útil, especialmente en la educación. Nos permite visualizar cómo los electrones se organizan y cómo interactúan con otros átomos. Además, muchos conceptos de química básica, como la formación de enlaces y la reactividad, se explican fácilmente utilizando este modelo.
Analogías para Comprender el Modelo de Bohr
Imagina un sistema solar en miniatura. El núcleo del átomo es como el sol, y los electrones son como los planetas que giran a su alrededor. Cada planeta tiene su propia órbita, y algunos están más cerca del sol que otros. Cuanto más lejos está un planeta del sol, más energía tiene. Sin embargo, si un planeta recibe un impulso, puede saltar a una órbita más lejana, pero eventualmente regresará a su posición original. Esta analogía ayuda a visualizar cómo los electrones se comportan en el modelo de Bohr.
El Átomo de Sodio en la Naturaleza
El sodio es un elemento omnipresente en la naturaleza. Se encuentra en grandes cantidades en el agua de mar y en muchos minerales. Su abundancia y reactividad lo convierten en un componente esencial en muchos procesos biológicos. Por ejemplo, el sodio es crucial para el funcionamiento de las células nerviosas en nuestro cuerpo. La transmisión de señales nerviosas depende de la entrada y salida de iones de sodio a través de las membranas celulares. Sin el sodio, nuestras funciones corporales se verían seriamente afectadas.
Aplicaciones del Sodio en la Vida Diaria
El sodio tiene muchas aplicaciones en nuestra vida cotidiana. Desde la sal que utilizamos en la cocina hasta el bicarbonato de sodio que se usa en productos de limpieza, este elemento es versátil. Además, en la industria, el sodio se utiliza en la producción de vidrio, en la fabricación de jabones y detergentes, y en la síntesis de productos químicos. Incluso se utiliza en la medicina, donde los compuestos de sodio se emplean en soluciones intravenosas y en la preservación de alimentos.
Preguntas Frecuentes
¿Cuál es la diferencia entre un átomo de sodio y un ion de sodio?
La principal diferencia radica en la cantidad de electrones. Un átomo de sodio neutro tiene 11 electrones, mientras que un ion de sodio (Na+) ha perdido un electrón, por lo que solo tiene 10 electrones. Esto le da una carga positiva.
¿Por qué el sodio es reactivo?
El sodio es reactivo debido a su único electrón en el nivel de energía más externo. Este electrón se puede perder fácilmente, permitiendo que el sodio se una a otros elementos para formar compuestos, como la sal.
¿El modelo de Bohr es el modelo más preciso para describir los átomos?
No, aunque el modelo de Bohr es útil y educativo, la mecánica cuántica moderna ofrece una descripción más precisa del comportamiento de los electrones en los átomos. Sin embargo, el modelo de Bohr sigue siendo un buen punto de partida para entender conceptos básicos.
¿Cómo afecta la estructura del sodio a su función en el cuerpo humano?
La estructura del sodio, especialmente su electrón de valencia, permite que interactúe fácilmente con otros elementos y compuestos. Esto es crucial para su papel en la transmisión de impulsos nerviosos y en el equilibrio de líquidos en el cuerpo.
¿Dónde se encuentra el sodio en la naturaleza?
El sodio se encuentra en abundancia en el agua de mar y en varios minerales. También se extrae de la sal común y se utiliza en muchas aplicaciones industriales y biológicas.
Así que, la próxima vez que veas sal en tu mesa, recuerda que estás mirando un elemento fundamental con una estructura atómica que es tanto simple como extraordinaria. ¡El sodio y su modelo atómico de Bohr son un verdadero testimonio de la belleza de la química!