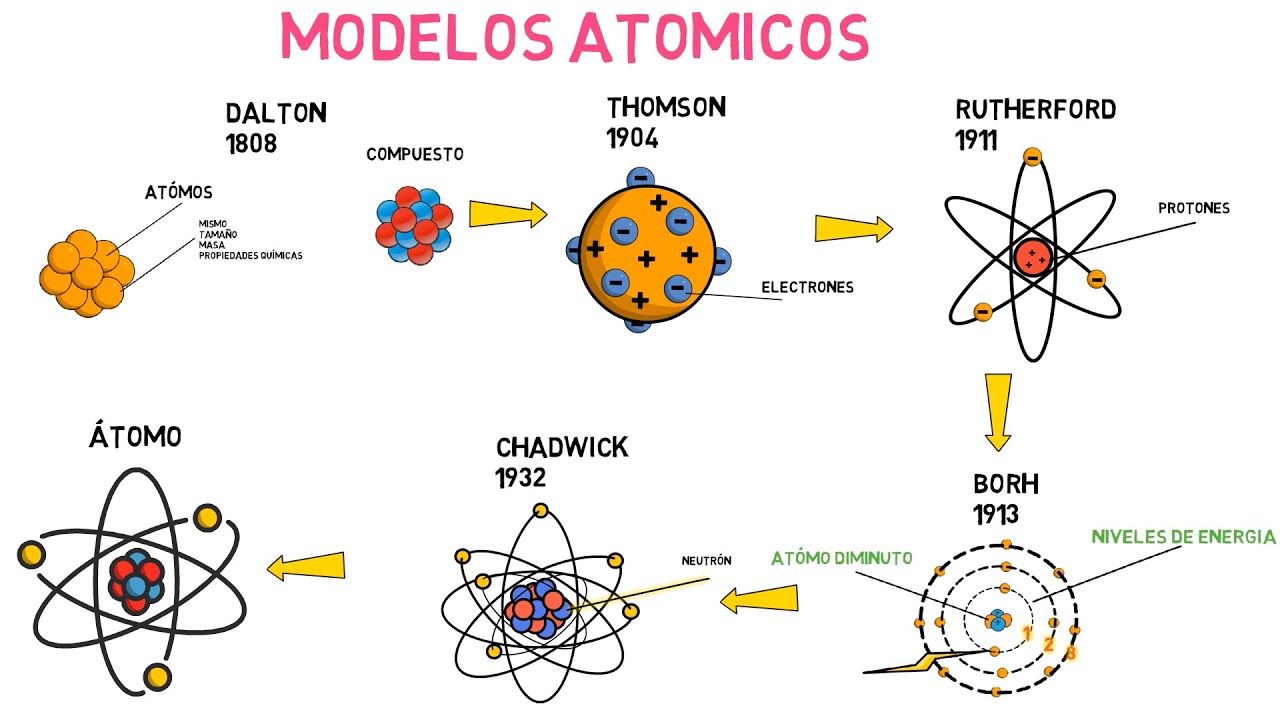
Línea del Tiempo de la Teoría Atómica: Evolución de los Modelos Atómicos a lo Largo de la Historia
Introducción a la Teoría Atómica
La historia de la teoría atómica es fascinante, ¿no te parece? Desde los antiguos filósofos griegos hasta los científicos modernos, la búsqueda de entender la materia ha sido un viaje lleno de descubrimientos sorprendentes y a veces, hasta confusos. La idea de que todo lo que vemos y tocamos está compuesto por pequeñas partículas invisibles ha evolucionado enormemente a lo largo de los siglos. Así que, si alguna vez te has preguntado cómo llegamos a entender lo que es un átomo, acompáñame en este recorrido a través de la línea del tiempo de la teoría atómica. ¡Vamos a desmenuzar este tema tan interesante!
Los Primeros Pasos: Filosofía y Teoría Atómica
Comencemos nuestro viaje en la antigua Grecia, alrededor del siglo V a.C. Aquí es donde encontramos a un personaje clave: Demócrito. Este filósofo propuso que todo estaba compuesto por pequeñas partículas indivisibles llamadas «átomos». Aunque su idea no fue aceptada de inmediato, es fascinante pensar que ya en ese entonces alguien se cuestionaba la naturaleza de la materia. Demócrito imaginó que los átomos eran eternos y que, aunque no se podían ver, eran la base de todo lo que existía. Pero, ¿qué pasó con su teoría? Bueno, fue en gran parte olvidada durante siglos, en parte por la influencia de Aristóteles, quien creía que todo estaba hecho de cuatro elementos: tierra, aire, fuego y agua.
El Renacimiento y el Resurgimiento del Atomismo
Pasaron muchos siglos antes de que la idea de los átomos volviera a cobrar vida. Durante el Renacimiento, la curiosidad por la naturaleza y la ciencia floreció. A finales del siglo XVII, el químico Robert Boyle empezó a cuestionar la naturaleza de la materia. Aunque no usó el término «átomo», sus experimentos sentaron las bases de la química moderna. Boyle defendía que los elementos eran sustancias puras que no podían ser descompuestas. Esto fue un paso importante hacia la aceptación del atomismo. Pero, ¿cómo se dio el gran salto hacia la teoría atómica moderna? Ah, eso es una historia que involucra a un par de genios.
La Era Moderna: La Teoría Atómica de Dalton
Entramos en el siglo XIX, donde John Dalton propuso su famosa teoría atómica en 1803. Dalton, un profesor de química, formuló una serie de postulados que revolucionaron la forma en que entendemos la materia. En resumen, sus ideas eran que los elementos estaban compuestos por átomos, que todos los átomos de un mismo elemento eran idénticos y que los compuestos se formaban mediante la unión de átomos de diferentes elementos. ¡Imagina el impacto que tuvo esto! Era como si se encendiera una luz en la oscuridad de la ignorancia. Pero, claro, esto era solo el principio.
El Descubrimiento del Electrón
Avancemos un poco más en el tiempo, a finales del siglo XIX. En 1897, el físico J.J. Thomson hizo un descubrimiento asombroso: ¡el electrón! Utilizando un tubo de rayos catódicos, Thomson demostró que los átomos no eran indivisibles como había propuesto Dalton, sino que estaban compuestos por partículas más pequeñas. Este descubrimiento llevó a la creación del modelo del «pudín de ciruelas», donde los electrones estaban incrustados en una «masa» positiva. Aunque este modelo fue revolucionario, no tardó en ser cuestionado. ¿Te imaginas lo que se siente ser un científico en ese momento, viendo cómo tus ideas son desafiadas?
El Modelo Planetario de Rutherford
Avancemos hasta 1911, cuando Ernest Rutherford llevó las cosas a un nuevo nivel. En su famoso experimento de dispersión de partículas alfa, Rutherford demostró que el átomo tenía un núcleo pequeño y denso, cargado positivamente. Este descubrimiento fue fundamental, ya que cambió la forma en que veíamos la estructura atómica. En lugar de ser una masa homogénea, los átomos eran como un sistema solar en miniatura, con electrones orbitando alrededor de un núcleo central. Imagínate un pequeño planeta girando alrededor de una estrella brillante; así era como Rutherford visualizaba el átomo. Sin embargo, este modelo también planteó nuevas preguntas. ¿Cómo podían los electrones, que se mueven a gran velocidad, permanecer en órbita sin caer en el núcleo? ¡La ciencia siempre tiene más sorpresas!
El Modelo Cuántico: La Revolución de Bohr
En 1913, el físico Niels Bohr propuso una solución a este dilema. Su modelo cuántico del átomo introdujo la idea de que los electrones ocupan niveles de energía específicos, y solo pueden moverse entre ellos al absorber o emitir energía. Esto fue un gran avance, ya que proporcionó una explicación coherente sobre cómo los electrones podían orbitar sin caer en el núcleo. La idea de los niveles de energía es similar a las escaleras: los electrones pueden subir o bajar de un peldaño a otro, pero no pueden estar entre ellos. Este modelo fue fundamental para entender la espectroscopía y la química, y abrió la puerta a la era moderna de la física cuántica.
Avances en la Física Cuántica
Con el tiempo, la física cuántica se desarrolló aún más, y científicos como Werner Heisenberg y Erwin Schrödinger hicieron contribuciones significativas. Heisenberg, con su principio de incertidumbre, nos enseñó que no se puede conocer simultáneamente la posición y la velocidad de un electrón con precisión. Por otro lado, Schrödinger desarrolló la famosa ecuación que describe cómo los electrones se comportan como ondas. La idea de que los electrones tienen propiedades tanto de partículas como de ondas es un concepto fundamental en la mecánica cuántica y, sinceramente, puede volarte la cabeza.
La Teoría Cuántica y la Estructura Atómica
En la actualidad, utilizamos la teoría cuántica para describir la estructura atómica. La idea de orbitales, donde los electrones se encuentran en «nubes» de probabilidad, ha reemplazado el modelo planetario de Bohr. En lugar de pensar en electrones como pequeñas bolas girando alrededor de un núcleo, ahora los vemos como «nubes» que representan la probabilidad de encontrar un electrón en un lugar determinado. ¡Es una forma totalmente nueva de entender lo que sucede dentro de un átomo!
Aplicaciones de la Teoría Atómica en la Vida Diaria
Ahora que hemos recorrido la historia de la teoría atómica, es interesante reflexionar sobre cómo todo esto afecta nuestra vida cotidiana. Desde la medicina hasta la tecnología, la comprensión de los átomos y las interacciones atómicas es fundamental. Por ejemplo, la energía nuclear, que se basa en la fisión de núcleos atómicos, ha revolucionado la producción de energía. Además, la química, que se basa en la teoría atómica, está en el corazón de todo, desde los medicamentos que tomamos hasta los productos que usamos diariamente.
Futuro de la Teoría Atómica
A medida que continuamos explorando el mundo a nivel subatómico, surgen nuevas preguntas y desafíos. ¿Qué hay de la materia oscura y la energía oscura? ¿Cómo podemos aplicar la teoría cuántica a la computación? La ciencia nunca se detiene, y cada descubrimiento abre nuevas puertas. El futuro de la teoría atómica es emocionante, y quién sabe qué nuevas revelaciones nos esperan.
Preguntas Frecuentes
¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesto por un núcleo central que contiene protones y neutrones, rodeado por electrones que orbitan a su alrededor.
¿Quién fue el primer científico en proponer la teoría atómica?
El filósofo griego Demócrito fue uno de los primeros en proponer la idea de que la materia está compuesta por pequeñas partículas indivisibles llamadas átomos.
¿Qué descubrió J.J. Thomson?
J.J. Thomson descubrió el electrón en 1897, lo que demostró que los átomos no son indivisibles, como se pensaba anteriormente.
¿Qué es el modelo cuántico del átomo?
El modelo cuántico describe a los electrones como «nubes» de probabilidad en lugar de partículas fijas, lo que refleja su comportamiento tanto de partículas como de ondas.
¿Cómo se aplica la teoría atómica en la vida cotidiana?
La teoría atómica es fundamental en muchos aspectos de nuestra vida diaria, incluyendo la medicina, la tecnología y la producción de energía, entre otros.
Este artículo ofrece una visión general de la evolución de la teoría atómica a lo largo de la historia, incluyendo sus hitos más importantes y su relevancia en el mundo moderno. ¡Espero que lo encuentres útil y entretenido!