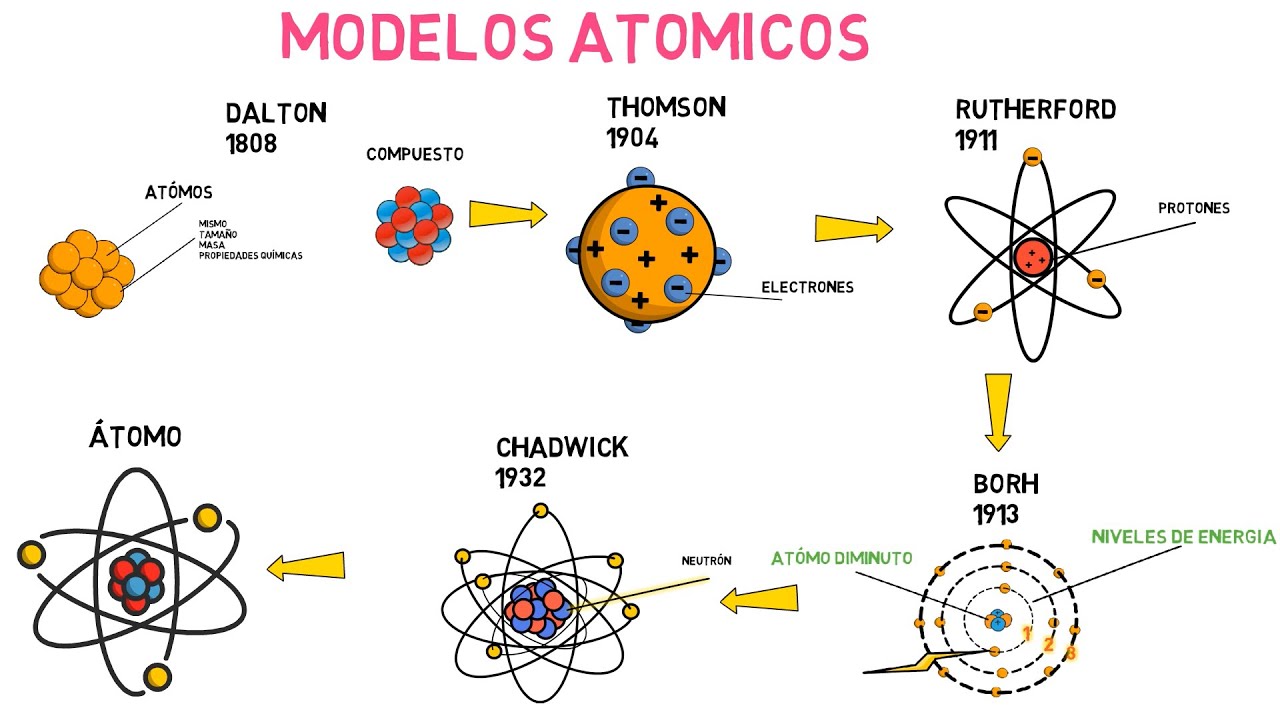
Linea del Tiempo de la Evolución del Modelo Atómico: Desde Dalton hasta la Teoría Cuántica
Un Viaje a Través de la Historia de la Ciencia
¿Alguna vez te has preguntado cómo llegamos a entender lo que compone el mundo a nuestro alrededor? La historia del modelo atómico es como un rompecabezas que se ha ido armando con el tiempo, pieza por pieza, gracias a la curiosidad y el ingenio de científicos a lo largo de los siglos. Desde la idea de que todo está hecho de pequeñas partículas indivisibles hasta la complejidad de la mecánica cuántica, cada avance ha sido crucial para nuestra comprensión del universo. En este artículo, vamos a hacer un recorrido fascinante por la evolución del modelo atómico, explorando cada etapa y sus protagonistas. Así que, ¡ajusta tu cinturón, que este viaje va a ser emocionante!
Los Primeros Pasos: Dalton y la Teoría Atómica
Todo comenzó en el siglo XIX con John Dalton, un químico inglés que, en 1803, propuso la primera teoría atómica moderna. Dalton imaginó que la materia estaba compuesta por átomos, que eran esferas pequeñas e indivisibles. Aunque su idea era rudimentaria, marcó un hito en la ciencia. Dalton también estableció que los átomos de diferentes elementos eran distintos entre sí, como si cada tipo de átomo fuera una pieza única de un rompecabezas. Imagina que cada elemento en la tabla periódica es una pieza que encaja perfectamente en el gran cuadro de la materia. Este concepto de indivisibilidad fue revolucionario, pero como veremos, no duraría mucho.
La Ley de Conservación de la Masa
Dalton no estaba solo en su búsqueda; sus ideas se basaron en las leyes de conservación de la masa de Antoine Lavoisier. Lavoisier demostró que, en una reacción química, la masa total de los reactivos es igual a la masa total de los productos. Si lo piensas bien, esto es como una balanza; lo que entra debe salir, y nada se pierde. Esta ley se convirtió en un pilar fundamental de la química y proporcionó un marco sólido para que Dalton desarrollara su teoría atómica.
El Descubrimiento del Electrón: Thomson y el Pudin de Pasas
Avancemos un poco en el tiempo, ahora estamos en 1897. El físico británico J.J. Thomson realizó experimentos con rayos catódicos y, para sorpresa de muchos, descubrió el electrón. Esto significaba que los átomos no eran tan indivisibles como se pensaba; estaban compuestos de partículas aún más pequeñas. Thomson propuso un nuevo modelo atómico, conocido como el «modelo del pudin de pasas». En este modelo, los electrones estaban incrustados en una «masa» positiva, como las pasas en un pudin. Aunque esta analogía era útil, también era bastante simplista. ¿Te imaginas un pudin de pasas en el que las pasas pudieran salir volando en cualquier momento? Eso es más o menos lo que estaba insinuando Thomson.
El Modelo de Thomson y sus Limitaciones
El modelo de Thomson fue un gran avance, pero no pudo explicar todas las propiedades de los átomos. Por ejemplo, no podía explicar cómo los electrones se organizan en torno al núcleo o por qué algunos átomos eran más estables que otros. Así que, como suele suceder en la ciencia, la búsqueda de respuestas continuó. Esto nos lleva al siguiente gran protagonista de nuestra historia: Ernest Rutherford.
Rutherford y el Núcleo Atómico
En 1911, Ernest Rutherford llevó a cabo su famoso experimento de la lámina de oro, donde bombardeó una fina lámina de oro con partículas alfa. Los resultados fueron sorprendentes: la mayoría de las partículas pasaron a través de la lámina, pero algunas se desviaron. ¿Qué significaba esto? Rutherford concluyó que los átomos tenían un núcleo pequeño y denso, cargado positivamente, donde se concentraba casi toda la masa del átomo. Este descubrimiento fue como encontrar el corazón de un edificio: una pequeña parte que sostiene todo lo demás.
El Modelo Planetario de Rutherford
Con esta nueva información, Rutherford propuso un modelo atómico en el que los electrones orbitan alrededor del núcleo, similar a cómo los planetas giran alrededor del sol. Aunque esta imagen era más precisa que la de Thomson, todavía había preguntas sin respuesta. ¿Por qué no se caen los electrones en el núcleo debido a la atracción gravitatoria? Este enigma llevó a la siguiente etapa de nuestra historia: la llegada de Niels Bohr.
Bohr y la Cuantización de la Energía
En 1913, Niels Bohr presentó su modelo atómico que incorporaba conceptos de la teoría cuántica. Propuso que los electrones se movían en órbitas fijas alrededor del núcleo y que podían saltar de una órbita a otra al absorber o emitir energía en forma de fotones. Este modelo fue como ponerle una banda de seguridad a la montaña rusa: ahora teníamos una explicación de por qué los electrones no se caían en el núcleo. Sin embargo, el modelo de Bohr también tenía sus limitaciones, especialmente cuando se trataba de átomos más complejos.
Las Líneas de Emisión y el Espectro de Hidrógeno
Una de las grandes contribuciones de Bohr fue explicar el espectro de emisión del hidrógeno. Al observar las líneas de emisión, Bohr pudo demostrar que los electrones solo podían existir en ciertos niveles de energía. Imagina que estás en un concierto y solo puedes estar en ciertas secciones del estadio; así es como funcionan los electrones en los átomos. Sin embargo, a medida que se exploraban otros elementos, quedó claro que necesitábamos un modelo más robusto para describir la complejidad de los átomos. Esto nos lleva a la revolución cuántica.
La Revolución Cuántica y el Modelo Cuántico
En la década de 1920, la física cuántica comenzó a tomar forma gracias a figuras como Werner Heisenberg y Erwin Schrödinger. Heisenberg formuló el principio de incertidumbre, que establece que no se puede conocer simultáneamente la posición y la velocidad de un electrón. Esto significa que, en lugar de orbes fijas, los electrones se encuentran en nubes de probabilidad. Imagina tratar de atrapar humo con las manos: puedes saber dónde está la mayor parte, pero no puedes tener una imagen exacta de su forma.
El Modelo Cuántico y la Dualidad Onda-Partícula
El modelo cuántico también introdujo la idea de la dualidad onda-partícula, que sugiere que los electrones pueden comportarse tanto como partículas como ondas. Esto fue un cambio de juego. En lugar de ver los electrones como pequeñas pelotas que giran alrededor del núcleo, ahora los entendemos como entidades mucho más complejas. Este nuevo enfoque abrió la puerta a muchas aplicaciones modernas, desde la computación cuántica hasta la teoría de la relatividad. ¿No es asombroso cómo una simple idea puede revolucionar nuestra comprensión del mundo?
Aplicaciones Modernas de la Teoría Cuántica
Hoy en día, la teoría cuántica no solo es fundamental en la física, sino que también ha encontrado su camino en la tecnología moderna. Desde la creación de semiconductores y láseres hasta la resonancia magnética, las aplicaciones son innumerables. Imagina que cada vez que usas tu teléfono o te haces una resonancia magnética, estás aprovechando los principios que se desarrollaron a partir de la evolución del modelo atómico. ¡Es un legado que sigue impactando nuestras vidas!
La Ciencia en el Futuro
A medida que continuamos explorando los misterios del universo, el modelo atómico seguirá evolucionando. Nuevas teorías y descubrimientos están a la vuelta de la esquina, y quién sabe qué más aprenderemos sobre la naturaleza de la materia y la energía. La ciencia nunca se detiene; siempre está en movimiento, como un río que fluye constantemente.
Preguntas Frecuentes
¿Qué es el modelo atómico?
El modelo atómico es una representación de la estructura y comportamiento de los átomos. Ha evolucionado a lo largo del tiempo, desde la idea de átomos indivisibles hasta la complejidad de la mecánica cuántica.
¿Quién fue el primer científico en proponer la teoría atómica?
John Dalton fue el primero en proponer una teoría atómica moderna en el siglo XIX, aunque la idea de que la materia está compuesta por partículas no es nueva.
¿Por qué es importante el modelo cuántico?
El modelo cuántico es crucial porque nos permite entender el comportamiento de los electrones y otros fenómenos a nivel subatómico, lo que tiene implicaciones en la química, la física y la tecnología moderna.
¿Qué aplicaciones tiene la teoría cuántica hoy en día?
La teoría cuántica se aplica en diversas áreas, como la computación cuántica, la resonancia magnética, los láseres y la tecnología de semiconductores, entre otros.
¿Cómo ha cambiado nuestra comprensión del átomo a lo largo del tiempo?
Nuestra comprensión del átomo ha evolucionado desde la idea de partículas indivisibles hasta un modelo complejo que incluye la mecánica cuántica, mostrando que los electrones no son simplemente pequeñas esferas, sino entidades que se comportan como ondas y partículas.