Todo sobre la Ley de Proust: Comprendiendo la Ley de las Proporciones Constantes
Introducción a la Ley de Proust
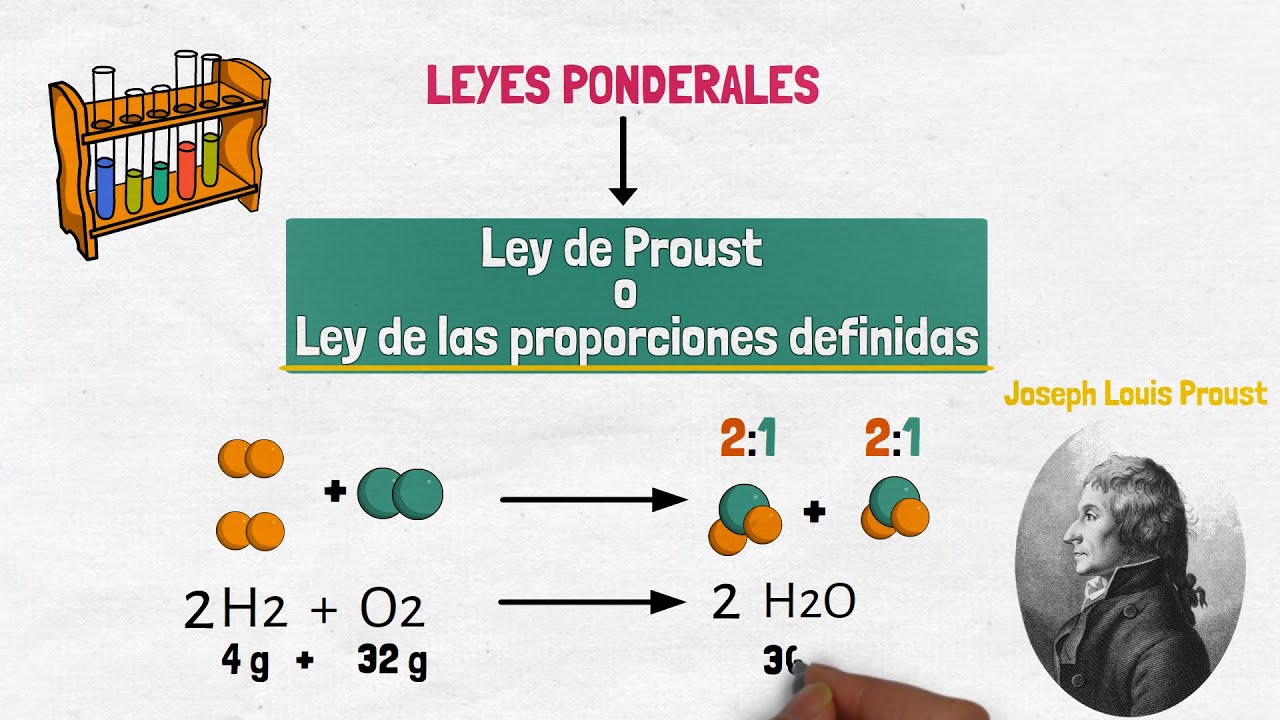
La Ley de Proust, también conocida como la Ley de las Proporciones Constantes, es un concepto fundamental en la química que nos ayuda a entender cómo se combinan los elementos para formar compuestos. Imagina que estás en una cocina, preparando una receta de galletas. Para que salgan perfectas, necesitas una cantidad específica de cada ingrediente: una taza de azúcar, dos tazas de harina, y así sucesivamente. Si cambias las proporciones, lo que obtendrás será algo completamente diferente, ¿verdad? De manera similar, la Ley de Proust establece que en cualquier compuesto químico, los elementos se combinan en proporciones fijas y definidas.
Pero, ¿por qué es tan importante esta ley? Bueno, a lo largo de la historia, muchos científicos han intentado comprender cómo se forman las sustancias químicas y por qué tienen las propiedades que tienen. La Ley de Proust, formulada por el químico francés Joseph Louis Proust a finales del siglo XVIII, nos brinda una respuesta clara. Proust observó que, sin importar cómo se obtuvieran los compuestos, la relación entre los elementos siempre permanecía constante. Así, si tomamos el agua, por ejemplo, siempre estará compuesta por dos átomos de hidrógeno y uno de oxígeno (H2O). Si añades más hidrógeno o más oxígeno, ya no tendrás agua, sino otra cosa. ¡Interesante, ¿verdad?!
La Historia Detrás de la Ley de Proust
La historia de la Ley de Proust es fascinante y está llena de descubrimientos y debates científicos. En el siglo XVIII, la química estaba en sus primeras etapas de desarrollo. A medida que los científicos comenzaban a experimentar y observar, se dieron cuenta de que los elementos no se combinaban de cualquier manera, sino que seguían patrones específicos. Proust fue uno de los primeros en proponer que estos patrones eran constantes y predecibles.
Antes de Proust, otros científicos como Antoine Lavoisier ya habían establecido que los elementos se podían clasificar y que la masa de un compuesto debía ser igual a la suma de las masas de sus elementos constitutivos. Sin embargo, fue Proust quien llevó esta idea un paso más allá al afirmar que, independientemente de la fuente del compuesto, los elementos siempre se combinarían en las mismas proporciones. Su trabajo fue revolucionario y sentó las bases para el desarrollo de la química moderna.
El Experimento de Proust
Para demostrar su teoría, Proust realizó varios experimentos meticulosos. Uno de los más conocidos involucraba la combinación de cobre y oxígeno para formar óxido de cobre. Al medir cuidadosamente las cantidades de cada elemento, Proust pudo demostrar que, sin importar cómo se combinaban, la proporción siempre era la misma. Esto significaba que, si tomabas 8 gramos de oxígeno, siempre necesitarías 1 gramo de cobre para formar el mismo compuesto. Este hallazgo fue fundamental para validar su teoría de las proporciones constantes.
Aplicaciones de la Ley de Proust en la Química Moderna
Ahora que hemos entendido los fundamentos de la Ley de Proust, es importante ver cómo se aplica en la química moderna. Esta ley es la base para muchos conceptos en química, incluyendo la formulación de compuestos, la estequiometría y la comprensión de las reacciones químicas.
Formulación de Compuestos
Cuando los químicos crean nuevas sustancias, deben tener en cuenta la Ley de Proust. Por ejemplo, al sintetizar un nuevo fármaco, los científicos deben asegurarse de que los elementos se combinen en las proporciones correctas para garantizar que el compuesto tenga la eficacia deseada. Esto es crucial en la industria farmacéutica, donde pequeñas variaciones en la proporción de ingredientes pueden llevar a resultados completamente diferentes.
Estequiometría
La estequiometría es la parte de la química que se ocupa de las relaciones cuantitativas entre los reactivos y los productos en una reacción química. La Ley de Proust es fundamental para la estequiometría, ya que permite a los químicos predecir cuántos gramos de un reactivo se necesitan para producir una cierta cantidad de producto. Sin esta ley, sería mucho más difícil calcular las cantidades necesarias en una reacción, lo que podría llevar a experimentos ineficaces o peligrosos.
Ejemplos de la Ley de Proust en la Vida Cotidiana
La Ley de Proust no es solo un concepto teórico; también tiene aplicaciones prácticas en nuestra vida diaria. Desde la cocina hasta la fabricación de productos, las proporciones constantes son clave en muchos aspectos.
Cocina y Repostería
Volviendo a nuestra analogía de la cocina, la Ley de Proust se puede ver claramente en la repostería. Cuando horneamos un pastel, seguimos una receta que indica las proporciones exactas de ingredientes. Si decides añadir más harina sin ajustar la cantidad de azúcar, el resultado final será un pastel que no sabe como debería. Así, al igual que en la química, las proporciones son esenciales para obtener el resultado deseado.
Industria de Alimentos
En la industria de alimentos, la Ley de Proust se aplica al mezclar ingredientes para producir productos como salsas, aderezos o bebidas. Las empresas deben seguir proporciones específicas para garantizar que el sabor y la textura sean consistentes en cada lote. Si una empresa cambia la proporción de ingredientes, el producto puede no satisfacer las expectativas de los consumidores.
Desafíos y Críticas a la Ley de Proust
A pesar de su importancia, la Ley de Proust no ha estado exenta de críticas y desafíos. Algunos científicos han argumentado que, en ciertas condiciones, los compuestos pueden formarse en proporciones variables. Sin embargo, estos casos suelen ser la excepción y no la regla.
Excepciones a la Regla
Un ejemplo de esto son los compuestos que forman soluciones. En una solución, los solutos pueden disolverse en diferentes proporciones dependiendo de la temperatura, la presión y otros factores. Sin embargo, incluso en estos casos, una vez que se establece una concentración, las proporciones se mantienen constantes.
La Evolución de la Química
A medida que la química ha evolucionado, también lo ha hecho nuestra comprensión de la materia. Las teorías modernas, como la teoría atómica y la teoría de enlaces químicos, han ampliado nuestra visión sobre cómo los elementos interactúan entre sí. A pesar de esto, la Ley de Proust sigue siendo una piedra angular en la química y un recordatorio de la importancia de las proporciones en la ciencia.
Preguntas Frecuentes
¿Qué es la Ley de Proust en términos simples?
La Ley de Proust establece que en un compuesto químico, los elementos se combinan siempre en proporciones fijas y constantes, sin importar cómo se obtengan.
¿Por qué es importante la Ley de Proust en la química?
Es fundamental porque permite a los científicos predecir cómo se combinan los elementos y calcular las cantidades necesarias en reacciones químicas, lo que es esencial en la investigación y la industria.
¿Hay excepciones a la Ley de Proust?
Sí, aunque la ley es muy confiable, hay algunas excepciones, especialmente en soluciones donde las proporciones pueden variar según las condiciones. Sin embargo, en general, las proporciones en los compuestos se mantienen constantes.
¿Cómo se aplica la Ley de Proust en la cocina?
En la cocina, la Ley de Proust se manifiesta al seguir recetas que requieren proporciones específicas de ingredientes. Cambiar estas proporciones puede afectar el sabor y la textura de los platillos.
¿Quién fue Joseph Louis Proust?
Joseph Louis Proust fue un químico francés que formuló la Ley de las Proporciones Constantes a finales del siglo XVIII, revolucionando la forma en que entendemos la química y la composición de los compuestos.
Este artículo aborda de manera integral la Ley de Proust, sus implicaciones y aplicaciones, y proporciona un estilo conversacional para involucrar al lector.