La Función de los Electrones de Valencia: Clave en la Química y la Formación de Enlaces
Introducción a los Electrones de Valencia
¿Alguna vez te has preguntado qué hace que los átomos se unan entre sí para formar todo lo que vemos a nuestro alrededor? Desde el agua que bebes hasta el aire que respiras, todo está compuesto por átomos que, a su vez, se unen gracias a los electores de valencia. Estos pequeños, pero poderosos, electrones son los verdaderos protagonistas en la química. En este artículo, nos adentraremos en el fascinante mundo de los electrones de valencia, explorando su papel en la formación de enlaces y cómo determinan las propiedades de las sustancias. Así que, ¡prepárate para un viaje emocionante a través del universo atómico!
### ¿Qué Son los Electrones de Valencia?
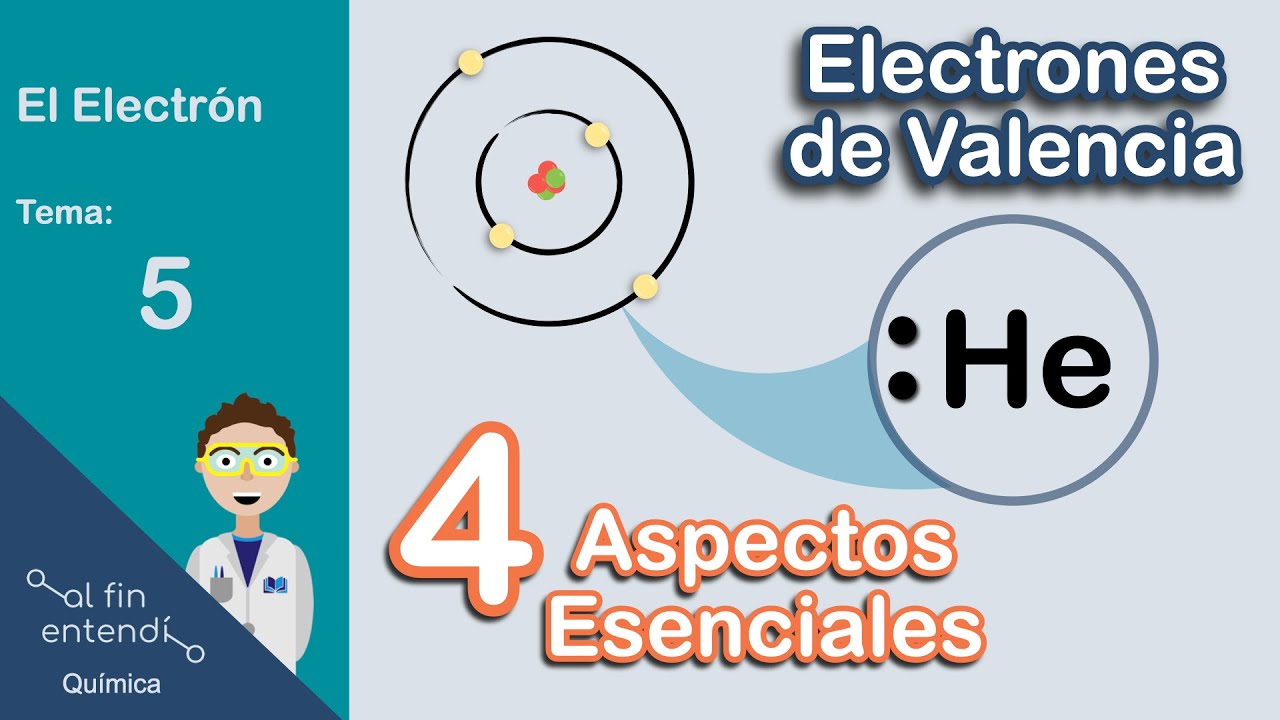
Primero, hablemos de qué son realmente los electrones de valencia. En términos simples, son los electrones que se encuentran en la capa más externa de un átomo. Imagina a un átomo como un pequeño sistema solar, donde el núcleo es el sol y los electrones son los planetas que orbitan a su alrededor. Los electrones de valencia son esos planetas que están más alejados del sol y, por lo tanto, son los más propensos a interactuar con otros átomos.
Estos electrones son cruciales porque son los responsables de la formación de enlaces químicos. Cuando dos átomos se acercan, sus electrones de valencia pueden interactuar de diversas maneras: pueden ser compartidos, transferidos o incluso apantallados. Todo esto depende de la naturaleza de los átomos involucrados y de cómo se organizan esos electrones. Por ejemplo, los átomos de hidrógeno tienen un solo electrón de valencia, mientras que los átomos de oxígeno tienen seis. Esta diferencia en el número de electrones de valencia es lo que permite que el hidrógeno y el oxígeno se unan para formar agua.
### La Importancia de los Enlaces Químicos
#### Tipos de Enlaces Químicos
Ahora que sabemos qué son los electrones de valencia, es hora de explorar cómo estos pequeños héroes atómicos forman enlaces químicos. Existen principalmente tres tipos de enlaces: covalentes, iónicos y metálicos. Cada uno de estos enlaces tiene características únicas que determinan cómo se comportan las sustancias que forman.
1. Enlaces Covalentes: Este tipo de enlace ocurre cuando dos átomos comparten electrones de valencia. Es como si dos amigos se dieran la mano, compartiendo algo valioso entre ellos. Un ejemplo clásico es el enlace entre dos átomos de hidrógeno y un átomo de oxígeno para formar agua. En este caso, los electrones se comparten, lo que permite que ambos átomos alcancen una configuración más estable.
2. Enlaces Iónicos: A diferencia de los enlaces covalentes, los enlaces iónicos se forman cuando un átomo transfiere uno o más electrones de valencia a otro átomo. Este proceso crea iones: átomos que tienen carga eléctrica debido a la pérdida o ganancia de electrones. Por ejemplo, cuando un átomo de sodio (que tiene un electrón de valencia) se une a un átomo de cloro (que tiene siete electrones de valencia), el sodio pierde su electrón y se convierte en un ion positivo, mientras que el cloro gana un electrón y se convierte en un ion negativo. La atracción entre estos dos iones opuestos forma un enlace iónico, creando compuestos como la sal de mesa (NaCl).
3. Enlaces Metálicos: Los enlaces metálicos son un poco diferentes. En este caso, los electrones de valencia se mueven libremente entre un grupo de átomos metálicos. Imagina un baile en el que todos los bailarines (átomos) comparten su espacio y se mueven juntos. Esta «nube» de electrones libres es lo que le da a los metales sus propiedades únicas, como la conductividad eléctrica y térmica.
### Cómo los Electrones de Valencia Determinan las Propiedades de los Elementos
#### La Configuración Electrónica
La configuración electrónica de un átomo, que describe cómo se distribuyen sus electrones en las diferentes capas, es fundamental para entender su comportamiento químico. Los electrones de valencia son especialmente importantes porque determinan cómo un átomo interactuará con otros. Por ejemplo, los elementos en el mismo grupo de la tabla periódica tienen el mismo número de electrones de valencia y, por lo tanto, comparten propiedades químicas similares.
Imagina que los electrones de valencia son como la vestimenta que lleva una persona. Dos personas vestidas de manera similar (es decir, con el mismo número de electrones de valencia) probablemente se comportarán de manera similar en una fiesta. Por otro lado, alguien con un atuendo muy diferente podría destacar y actuar de forma distinta.
#### La Reactividad Química
La reactividad química de un elemento también está estrechamente relacionada con sus electrones de valencia. Elementos con un solo electrón de valencia, como el litio o el sodio, son altamente reactivos porque buscan deshacerse de ese electrón para alcanzar una configuración más estable. En contraste, los gases nobles, que tienen una capa de electrones de valencia completa, son muy estables y tienden a no reaccionar con otros elementos.
### La Relación entre Electrones de Valencia y la Estructura Molecular
#### Estructura de Lewis
Para visualizar cómo se organizan los electrones de valencia en una molécula, los químicos utilizan la estructura de Lewis. Este método representa los electrones de valencia como puntos alrededor del símbolo del elemento. Por ejemplo, el oxígeno, que tiene seis electrones de valencia, se representaría con seis puntos alrededor de su símbolo (O). Esto ayuda a los científicos a entender cómo se forman los enlaces y la geometría de las moléculas.
#### Geometría Molecular
La disposición de los electrones de valencia también influye en la geometría de una molécula. La teoría de repulsión de pares de electrones (VSEPR) sugiere que los electrones de valencia se repelen entre sí, lo que determina la forma de la molécula. Por ejemplo, el agua tiene una forma angular debido a la repulsión entre los pares de electrones no compartidos en el átomo de oxígeno.
### Aplicaciones Prácticas de los Electrones de Valencia
#### Química Orgánica
Los electrones de valencia son fundamentales en la química orgánica, que se centra en compuestos que contienen carbono. La capacidad del carbono para formar enlaces covalentes con otros átomos de carbono y elementos como hidrógeno, oxígeno y nitrógeno es lo que permite la diversidad de compuestos orgánicos. Desde el ADN hasta los plásticos, los electrones de valencia son responsables de la estructura y función de estas moléculas.
#### Materiales y Tecnología
En el mundo de los materiales, la comprensión de los electrones de valencia ha llevado a avances en la creación de nuevos compuestos y tecnologías. Por ejemplo, el desarrollo de semiconductores, que son fundamentales para la electrónica moderna, se basa en el comportamiento de los electrones de valencia en materiales como el silicio.
### Conclusiones
En resumen, los electrones de valencia son la clave para entender la química y la formación de enlaces. Desde la creación de moléculas simples hasta la construcción de compuestos complejos, estos electrones juegan un papel crucial en la forma en que interactúan los átomos. Al comprender su función, no solo apreciamos mejor la química, sino que también nos adentramos en el fascinante mundo de la materia que nos rodea.
### Preguntas Frecuentes
1. ¿Por qué los electrones de valencia son tan importantes en la química?
– Son los responsables de la formación de enlaces químicos, lo que permite que los átomos se unan y formen moléculas.
2. ¿Qué tipo de enlace se forma cuando los electrones se comparten?
– Se forma un enlace covalente.
3. ¿Cómo afecta la configuración electrónica a la reactividad de un elemento?
– Elementos con electrones de valencia incompletos son más reactivos, ya que buscan alcanzar una configuración más estable.
4. ¿Qué es la estructura de Lewis y por qué es útil?
– Es una representación que muestra la distribución de electrones de valencia en una molécula, ayudando a visualizar cómo se forman los enlaces.
5. ¿Cómo influyen los electrones de valencia en las propiedades de los materiales?
– Determinan la forma en que los átomos se unen y, por lo tanto, afectan las propiedades físicas y químicas de los materiales.