El Desarrollo del Modelo Atómico: Historia y Evolución de la Teoría Atómica
Introducción a la Teoría Atómica
La historia del modelo atómico es como una novela llena de giros inesperados, personajes intrigantes y descubrimientos sorprendentes. Desde la antigua Grecia hasta los laboratorios modernos, la idea de que la materia está compuesta por pequeñas partículas ha evolucionado de maneras que nunca hubiéramos imaginado. ¿Alguna vez te has preguntado cómo llegamos a entender que todo a nuestro alrededor, desde una simple hoja hasta las estrellas en el cielo, está formado por átomos? Acompáñame en este recorrido fascinante a través del tiempo, donde exploraremos los hitos más importantes en el desarrollo de la teoría atómica.
La historia comienza hace más de 2400 años, cuando un filósofo griego llamado Demócrito propuso que la materia estaba compuesta por pequeñas partículas indivisibles llamadas «átomos». Imagínate la escena: en una antigua plaza, este pensador se atreve a desafiar las creencias de su tiempo, sugiriendo que todo lo que vemos es el resultado de combinaciones de estas diminutas partículas. Sin embargo, la ciencia no avanzó mucho en este campo durante siglos. ¿Por qué? Porque la idea de que algo tan pequeño pudiera existir estaba más allá de la comprensión de la época. Fue solo hasta el siglo XIX que los científicos comenzaron a experimentar y a dar forma a lo que hoy conocemos como el modelo atómico.
Demócrito y la Idea Inicial del Átomo
Demócrito, aunque no era un científico en el sentido moderno, planteó preguntas que resonarían a lo largo de los siglos. Su noción de átomos como partículas indivisibles sentó las bases para la futura investigación. Pero, ¿qué pasó después? Durante mucho tiempo, su teoría fue ignorada en favor de las ideas más filosóficas de Platón y Aristóteles, quienes sostenían que la materia estaba compuesta por cuatro elementos: tierra, agua, aire y fuego.
No fue hasta el siglo XVII que la ciencia comenzó a tomar un rumbo diferente. Los alquimistas, en su búsqueda por entender la materia y transformar metales en oro, hicieron observaciones que sentaron las bases para la química moderna. A medida que se desarrollaron nuevas técnicas experimentales, se empezó a cuestionar la naturaleza de la materia. La pregunta seguía en el aire: ¿qué hay dentro de un átomo?
John Dalton y la Teoría Atómica Moderna
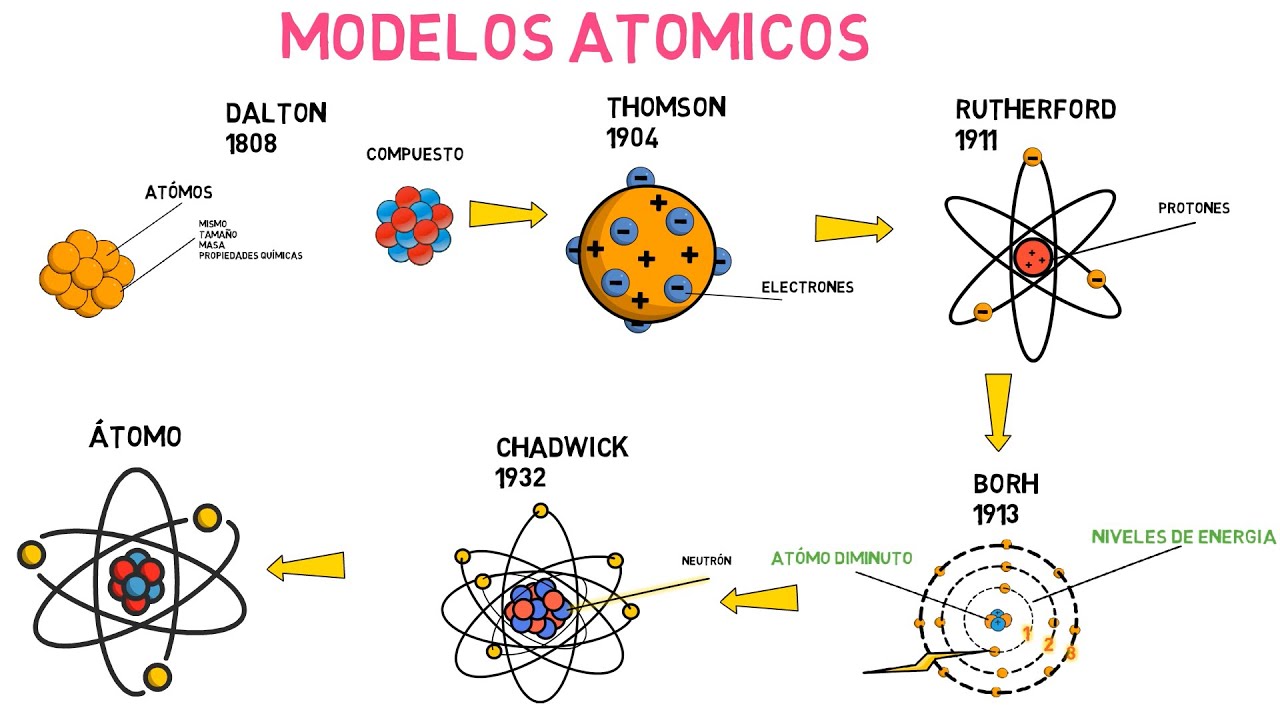
En el siglo XIX, John Dalton, un químico inglés, hizo un gran avance al formalizar la teoría atómica. Dalton propuso que cada elemento estaba compuesto por átomos de un solo tipo y que estos átomos eran indivisibles. Su famosa afirmación, «los átomos de diferentes elementos se combinan en proporciones simples para formar compuestos», fue revolucionaria. Imagina a Dalton como un maestro de rompecabezas, encajando piezas de diferentes formas y tamaños para crear algo completamente nuevo.
Pero, como ocurre en toda buena historia, la trama se complicó. Dalton no tenía idea de que los átomos en realidad podían ser divididos, y su modelo no incluía la existencia de electrones, protones o neutrones. Fue un paso importante, pero estaba lejos de ser la historia completa.
Avances en la Comprensión de la Electricidad y la Materia
El siglo XIX también fue testigo de avances en el estudio de la electricidad. Científicos como Michael Faraday y J.J. Thomson comenzaron a investigar la naturaleza de la materia a nivel atómico. Thomson, en particular, es conocido por su experimento con los tubos de rayos catódicos, donde descubrió el electrón en 1897. ¿Te imaginas la sorpresa de Thomson al darse cuenta de que había una partícula más pequeña que el átomo? Fue como encontrar un pequeño tesoro escondido en un mapa antiguo.
Thomson propuso el modelo del «pudín de ciruelas», donde los electrones estaban incrustados en una esfera positiva, como si fueran pasas en un pudín. Este modelo fue un intento de explicar cómo los átomos podían ser neutros a pesar de tener partículas cargadas. Sin embargo, no duró mucho tiempo antes de que otro científico desafiara esta idea.
Ernest Rutherford y el Descubrimiento del Núcleo
En 1911, Ernest Rutherford llevó a cabo su famoso experimento de dispersión de partículas alfa, que cambiaría para siempre nuestra comprensión del átomo. Al bombardear una lámina delgada de oro con partículas alfa, se sorprendió al descubrir que algunas de ellas se desviaban en ángulos inesperados. Esto llevó a la conclusión de que los átomos tenían un núcleo denso y positivo, rodeado de electrones en movimiento. ¡Vaya revelación! Rutherford fue como un explorador que, al abrir una puerta, se encontró en una sala llena de tesoros.
Su modelo atómico, conocido como el modelo planetario, representaba a los electrones girando alrededor del núcleo, similar a cómo los planetas orbitan alrededor del sol. Sin embargo, este modelo también tenía sus limitaciones. ¿Cómo podían los electrones, que están cargados negativamente, no caer en el núcleo positivo? La respuesta no llegó de inmediato.
Niels Bohr y la Cuantización de la Energía
En 1913, Niels Bohr propuso un nuevo modelo que incorporaba la idea de que los electrones solo podían existir en ciertas órbitas específicas alrededor del núcleo. Su modelo fue revolucionario, introduciendo la noción de niveles de energía cuantizados. ¿Qué significa esto? Imagina que los electrones son bailarines en un escenario, pero solo pueden moverse en ciertos lugares. Este modelo no solo resolvía el problema de la estabilidad de los electrones, sino que también explicaba la emisión de luz de los átomos, un fenómeno que intrigaba a los científicos.
Sin embargo, a medida que la investigación continuaba, los científicos se dieron cuenta de que el modelo de Bohr tenía limitaciones. En la década de 1920, el desarrollo de la mecánica cuántica trajo consigo nuevas ideas que desafiaron aún más nuestra comprensión de la materia.
La Mecánica Cuántica y el Modelo Cuántico del Átomo
La mecánica cuántica, una de las teorías más complejas y fascinantes de la física, se adentra en el comportamiento de las partículas subatómicas. Los científicos como Werner Heisenberg y Erwin Schrödinger hicieron contribuciones significativas a esta área. La famosa «incertidumbre de Heisenberg» nos dice que no podemos conocer con precisión tanto la posición como la velocidad de una partícula al mismo tiempo. Es como intentar atrapar a un pez escurridizo en un estanque; cuanto más intentas acercarte, más se aleja.
El modelo cuántico del átomo, que surgió de estas ideas, describe a los electrones no como partículas en órbitas fijas, sino como nubes de probabilidad. En lugar de pensar en electrones moviéndose en caminos predecibles, imagina una nube de polvo donde hay más probabilidades de encontrar partículas en ciertas áreas. Este modelo revolucionó nuestra comprensión de la materia y abrió la puerta a nuevas tecnologías, desde la electrónica hasta la medicina.
El Futuro de la Teoría Atómica
A medida que avanzamos en el siglo XXI, la investigación sobre el átomo continúa. Desde la exploración de partículas subatómicas como quarks y leptones hasta la búsqueda de la materia oscura y la energía oscura, la ciencia sigue desafiando nuestras nociones de lo que es la materia. Los avances en la tecnología nos permiten observar y manipular átomos y moléculas de maneras que antes eran impensables.
¿Y qué hay del futuro? La teoría atómica seguramente seguirá evolucionando. Quizás un día descubramos nuevas partículas que cambien por completo nuestra comprensión de la materia, o tal vez desarrollemos tecnologías que nos permitan utilizar átomos de maneras que aún no podemos imaginar.
Conclusión: La Maravilla del Mundo Atómico
La historia del modelo atómico es un viaje lleno de descubrimientos, desafíos y avances. Desde las ideas iniciales de Demócrito hasta las complejas teorías de la mecánica cuántica, cada paso ha sido crucial para formar nuestra comprensión actual de la materia. ¿Te imaginas lo que nos deparará el futuro? La ciencia es una aventura continua, y cada respuesta genera nuevas preguntas.
Preguntas Frecuentes:
¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesta por un núcleo central de protones y neutrones, rodeado por electrones que orbitan en diferentes niveles de energía.
¿Quién descubrió el electrón?
El electrón fue descubierto por J.J. Thomson en 1897 a través de experimentos con tubos de rayos catódicos.
¿Qué es la mecánica cuántica?
La mecánica cuántica es una rama de la física que estudia el comportamiento de las partículas subatómicas y describe cómo interactúan en niveles muy pequeños, a menudo desafiando nuestras nociones intuitivas de la realidad.
¿Cómo ha cambiado nuestra comprensión del átomo en los últimos años?
La comprensión del átomo ha evolucionado a través de avances en la tecnología y la teoría científica, permitiendo a los investigadores estudiar partículas subatómicas y explorar fenómenos como la materia oscura y la energía oscura.
¿Qué aplicaciones tiene la teoría atómica en la vida cotidiana?
La teoría atómica tiene múltiples aplicaciones en la vida cotidiana, desde la medicina (como en la tomografía computarizada y la terapia de radiación) hasta la electrónica (en dispositivos como teléfonos inteligentes y computadoras).
Este artículo proporciona un recorrido completo por la historia del modelo atómico, presentando los hitos y avances de una manera conversacional y accesible. ¡Espero que te haya resultado interesante!