La Evolución del Átomo a lo Largo de la Historia: Un Viaje Científico Fascinante
Introducción a la Historia del Átomo
¡Hola, querido lector! Hoy vamos a sumergirnos en un tema que ha fascinado a científicos, filósofos y curiosos a lo largo de la historia: el átomo. Pero, espera un momento, ¿qué es un átomo? En términos sencillos, es la unidad básica de la materia, la pequeña pieza de Lego que forma todo lo que vemos a nuestro alrededor. Desde la comida que comemos hasta el aire que respiramos, todo está hecho de átomos. Sin embargo, su historia es mucho más que solo una definición. Es un viaje épico lleno de descubrimientos, teorías y, a veces, incluso errores. Así que abróchate el cinturón y prepárate para explorar cómo nuestra comprensión del átomo ha evolucionado a lo largo del tiempo.
Los Primeros Pensadores: Demócrito y la Teoría Atómica
Volvamos un poco en el tiempo, hasta la antigua Grecia, alrededor del siglo V a.C. Aquí encontramos a un filósofo llamado Demócrito. Este tipo era un verdadero pionero, ¡un visionario! Él propuso que todo en el universo estaba compuesto de pequeñas partículas indivisibles que llamó «átomos». Imagínate a Demócrito en una playa, lanzando piedras al agua y pensando: «Si estas piedras son tan pequeñas que no puedo verlas, ¿no podrían existir otras aún más pequeñas que forman todo lo que veo?» Aunque sus ideas fueron revolucionarias, no contaba con la tecnología ni con la evidencia necesaria para respaldarlas, así que su teoría quedó en el aire, como un globo sin atar.
Aristóteles y el Rechazo de la Teoría Atómica
Ahora, hablemos de Aristóteles, otro gigante del pensamiento griego. A diferencia de Demócrito, Aristóteles tenía una visión diferente del mundo. Creía que todo estaba compuesto de cuatro elementos: tierra, aire, fuego y agua. Su influencia fue tan poderosa que las ideas de Demócrito quedaron en el olvido durante siglos. ¡Imagina tener una idea brillante y que nadie la escuche porque alguien más tiene una teoría más popular! Así fue como la teoría atómica se desvaneció, como un susurro en el viento.
El Renacimiento y el Resurgimiento de la Ciencia
Avancemos varios siglos, hasta el Renacimiento. Este fue un período de redescubrimiento y avance en el conocimiento. Los científicos comenzaron a cuestionar las ideas antiguas y a experimentar. Uno de los personajes más importantes de esta época fue Robert Boyle, quien es conocido por su trabajo en la química y la física. Boyle dijo: «Los átomos existen y son la base de la materia», y aunque su enfoque era más experimental, comenzó a sentar las bases para la ciencia moderna.
John Dalton y la Teoría Atómica Moderna
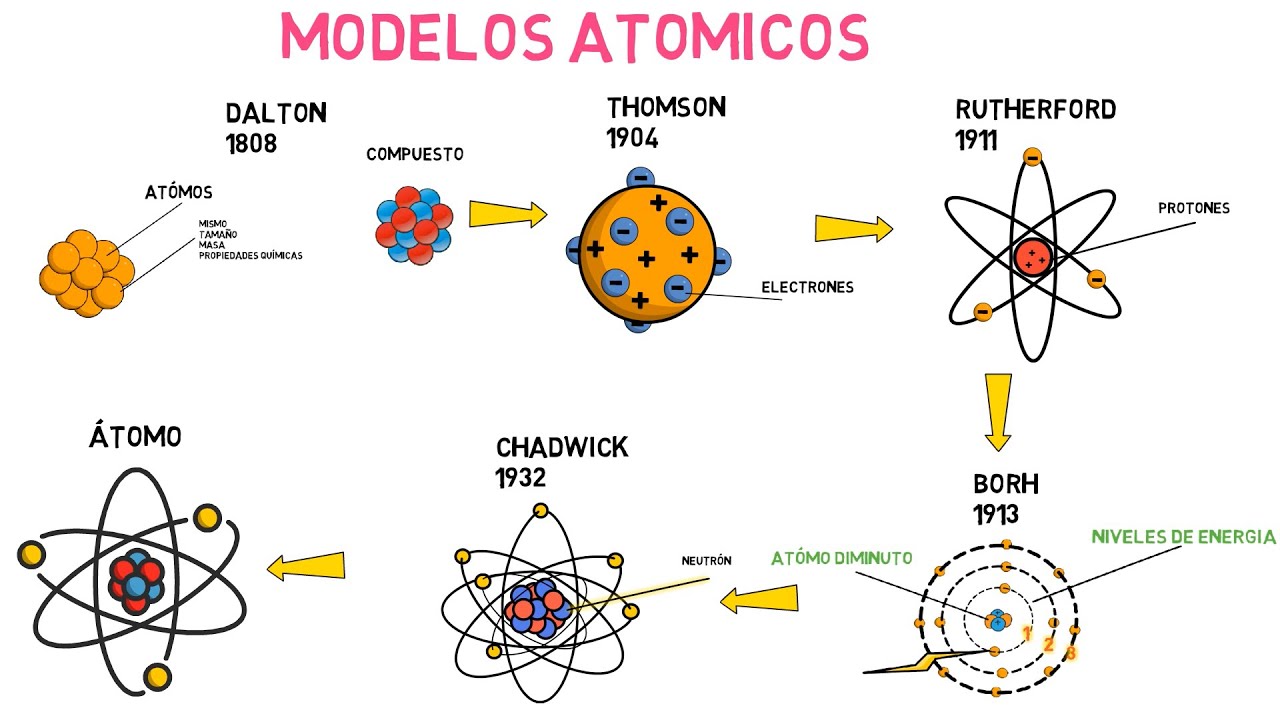
Luego, llegamos al siglo XIX y a un químico británico llamado John Dalton. Este tipo sí que estaba en la onda. Dalton propuso que cada elemento está formado por átomos de un tipo particular y que los átomos de diferentes elementos tienen diferentes masas. ¡Bingo! Aquí comenzamos a tener una idea más clara de lo que realmente es un átomo. Imagínate una tienda de dulces: cada tipo de dulce es un elemento y cada dulce dentro de esa categoría es un átomo. Esta idea de Dalton fue como encender una bombilla en la oscuridad de la ignorancia.
La Era de los Descubrimientos: Thomson, Rutherford y Bohr
La ciencia estaba en plena ebullición y, en este contexto, llegamos a otro hito: el descubrimiento del electrón por J.J. Thomson en 1897. Thomson utilizó un tubo de rayos catódicos y, al igual que un detective, descubrió que los átomos no eran indivisibles, sino que estaban compuestos de partículas aún más pequeñas. ¡Esto fue un verdadero terremoto en la comunidad científica! Thomson imaginó el átomo como un «pudín de pasas», donde las pasas eran los electrones incrustados en una masa positiva. Pero, como todo buen detective, otros comenzaron a cuestionar su teoría.
Ernest Rutherford y la Estructura del Núcleo
En 1909, Ernest Rutherford realizó un experimento que cambiaría la forma en que veíamos el átomo. Al bombardear una lámina de oro con partículas alfa, descubrió que la mayoría de las partículas pasaban a través, pero algunas se desviaban. ¿Qué significaba esto? Rutherford concluyó que el átomo tenía un núcleo denso y positivo en el centro, rodeado de electrones. Es como si estuvieras tratando de atravesar una puerta: si es delgada, puedes pasar sin problema, pero si es sólida, ¡te detendrás en seco!
Niels Bohr y la Cuantización de la Energía
Y aquí es donde entra en juego Niels Bohr, un físico danés que tomó las ideas de Rutherford y las mejoró. En 1913, Bohr propuso que los electrones orbitan alrededor del núcleo en niveles de energía específicos, como los planetas alrededor del sol. Este modelo fue un gran avance, ya que introdujo el concepto de cuantización de la energía, que es fundamental en la física moderna. ¿Alguna vez has visto un carrusel? Imagínate a los electrones montando en caballitos a diferentes alturas, cada uno con su propia energía. ¡Es un espectáculo!
La Teoría Cuántica y el Modelo de Schrödinger
Ahora, avancemos a la década de 1920, donde la teoría cuántica empezó a tomar forma. Con el trabajo de científicos como Max Planck y Albert Einstein, la física cuántica comenzó a cambiar nuestra percepción del átomo. Luego, el físico austríaco Erwin Schrödinger propuso un modelo que representaba a los electrones no como partículas en órbitas fijas, sino como ondas de probabilidad. Esto es como tratar de atrapar humo: no puedes decir exactamente dónde está, pero sabes que está en algún lugar. Su famosa ecuación de onda permitió a los científicos calcular la probabilidad de encontrar un electrón en una región específica alrededor del núcleo.
El Modelo de Nube de Electrones
El modelo de Schrödinger nos llevó a la idea de la «nube de electrones». En lugar de pensar en electrones viajando en caminos predecibles, ahora los imaginamos como una nube difusa de posibilidades. Es como si estuvieras en una fiesta y no supieras dónde están todos, pero tienes una idea general de que están en el área de baile. Esta comprensión fue un cambio de juego, que abrió las puertas a nuevas investigaciones y descubrimientos.
El Átomo en la Era Moderna
En las últimas décadas, nuestra comprensión del átomo ha avanzado aún más. La física de partículas ha revelado que los protones y neutrones, que forman el núcleo del átomo, también están compuestos de partículas más pequeñas llamadas quarks. Esto es como descubrir que las piezas de Lego que usabas de niño están hechas de materiales aún más diminutos. Además, el desarrollo de la tecnología de aceleradores de partículas ha permitido a los científicos explorar el mundo subatómico de maneras que antes eran inimaginables.
Aplicaciones Prácticas de la Teoría Atómica
Y aquí es donde la historia del átomo se vuelve aún más emocionante. Desde la energía nuclear hasta la medicina, los avances en nuestra comprensión del átomo han llevado a aplicaciones prácticas que han cambiado el mundo. Por ejemplo, la tecnología de imágenes médicas, como la resonancia magnética (RM) y la tomografía por emisión de positrones (PET), se basa en principios atómicos. ¿Quién diría que algo tan pequeño podría tener un impacto tan grande en nuestras vidas?
Reflexiones Finales sobre el Átomo
A medida que miramos hacia el futuro, la investigación sobre el átomo y sus componentes sigue en marcha. Con el desarrollo de la nanotecnología y la física cuántica, es posible que pronto descubramos más sobre los misterios del universo. ¿Te imaginas un mundo donde podamos manipular átomos a voluntad? Las posibilidades son infinitas. Así que la próxima vez que veas algo tan simple como una manzana, recuerda: en su interior hay un mundo entero de átomos, cada uno con su propia historia fascinante.
Preguntas Frecuentes
¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesto por un núcleo que contiene protones y neutrones, rodeado de electrones que orbitan a su alrededor.
¿Quién fue el primero en proponer la teoría atómica?
Demócrito fue uno de los primeros en proponer la idea de que todo estaba hecho de átomos, aunque su teoría no fue aceptada en su tiempo.
¿Qué descubrió J.J. Thomson?
J.J. Thomson descubrió el electrón en 1897, lo que llevó a la comprensión de que los átomos no son indivisibles.
¿Cómo ha cambiado nuestra comprensión del átomo en los últimos años?
La investigación en física de partículas ha revelado que los protones y neutrones están compuestos de quarks, lo que ha ampliado nuestra comprensión del modelo atómico.
¿Cuáles son algunas aplicaciones prácticas de la teoría atómica?
Las aplicaciones incluyen tecnologías como la energía nuclear, imágenes médicas y la nanotecnología, que tienen un impacto significativo en la vida cotidiana.