Desarrollo de la Teoría Atómica: Evolución y Contribuciones Clave en la Ciencia
La Búsqueda del Conocimiento: ¿Qué es la Teoría Atómica?
La teoría atómica es una de esas ideas que han cambiado el curso de la ciencia y nuestra comprensión del mundo. Pero, ¿qué es exactamente? En pocas palabras, la teoría atómica propone que toda la materia está compuesta por pequeñas unidades llamadas átomos. Imagina que los átomos son como las piezas de un rompecabezas, cada uno con su forma y tamaño, que se ensamblan para formar todo lo que vemos a nuestro alrededor: desde una hoja de árbol hasta el aire que respiramos. La historia de esta teoría es fascinante y está llena de giros inesperados, descubrimientos sorprendentes y contribuciones de mentes brillantes.
Desde la antigua Grecia hasta los laboratorios modernos, la evolución de la teoría atómica ha sido un viaje épico. ¿Quiénes fueron los pioneros que abrieron el camino? ¿Cuáles fueron los hitos más importantes en esta travesía científica? Acompáñame en este recorrido, donde desglosaremos los momentos clave, los personajes influyentes y cómo cada uno de ellos ha contribuido a lo que hoy entendemos sobre el átomo. La historia de la teoría atómica no es solo un relato de ciencia; es un testimonio del ingenio humano y de nuestra insaciable curiosidad por entender el universo.
Los Primeros Pasos: De los Filósofos Griegos a Dalton
La historia de la teoría atómica comienza en la antigua Grecia. Filósofos como Demócrito y Leucipo fueron los primeros en proponer que la materia estaba compuesta por partículas indivisibles. Imagina a Demócrito, un pensador con una mente curiosa, observando el mundo y preguntándose qué hay más allá de lo que podemos ver. Él introdujo la idea de que, si seguimos dividiendo la materia, eventualmente llegaremos a una partícula que no se puede dividir más: el átomo. Aunque sus ideas fueron revolucionarias, no tuvieron mucha aceptación en su época. La filosofía predominante de Aristóteles, que sostenía que todo estaba compuesto por cuatro elementos (tierra, agua, aire y fuego), se impuso por siglos.
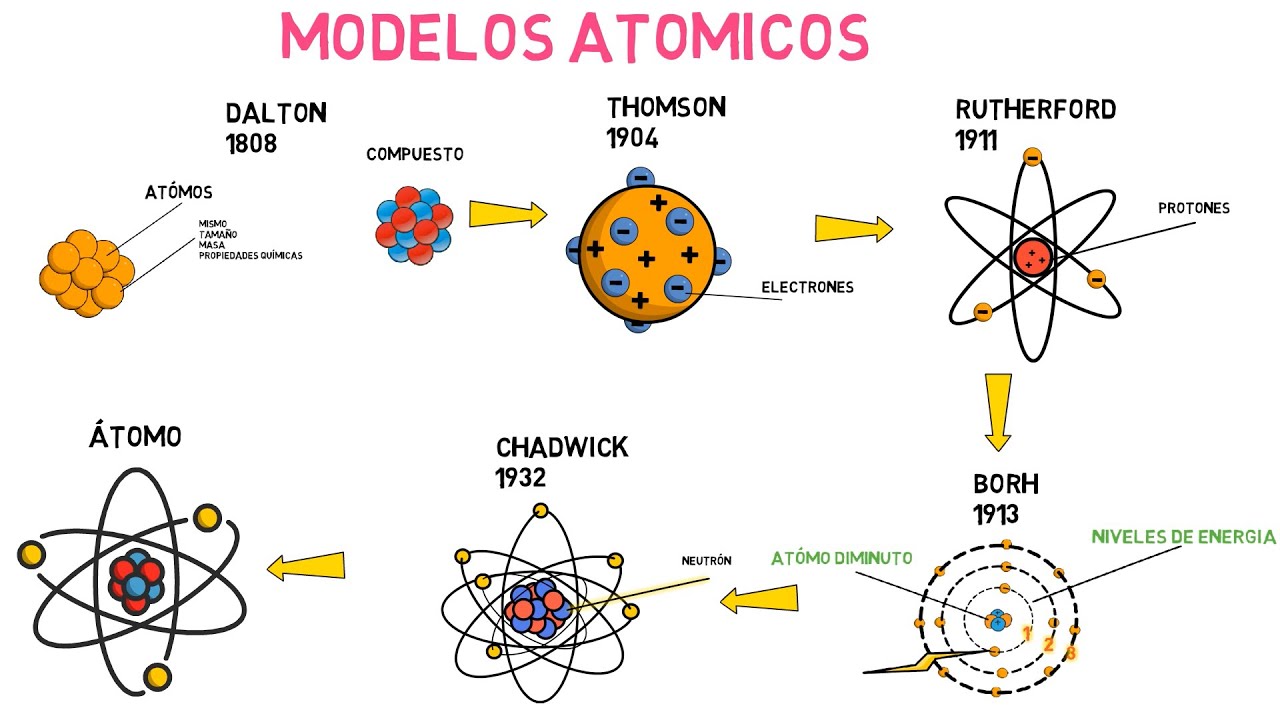
Fue en el siglo XIX cuando la teoría atómica comenzó a tomar forma científica. John Dalton, un químico británico, rescató la idea de los átomos y la presentó de manera más estructurada. Dalton propuso que cada elemento químico estaba formado por átomos de un tipo específico y que estos átomos se combinan en proporciones definidas para formar compuestos. Imagina que cada elemento es como un tipo de ladrillo, y los compuestos son las estructuras que construimos con esos ladrillos. Dalton también desarrolló la ley de las proporciones múltiples, que establece que los átomos de diferentes elementos pueden unirse en diferentes relaciones para formar compuestos distintos. Esta idea fue fundamental para el desarrollo posterior de la química.
Avances en la Comprensión: Thomson y el Modelo del Pudín de Ciruelas
A medida que la ciencia avanzaba, también lo hacía nuestra comprensión del átomo. A finales del siglo XIX, J.J. Thomson realizó experimentos con rayos catódicos y descubrió el electrón, una de las partículas subatómicas que componen el átomo. ¡Imagina la sorpresa de Thomson al darse cuenta de que había algo más pequeño que el átomo! Esto cambió las reglas del juego. Thomson propuso un nuevo modelo atómico, conocido como el modelo del pudín de ciruelas, que imaginaba al átomo como una esfera cargada positivamente con electrones incrustados en ella, como las ciruelas en un pudín. Aunque este modelo fue un avance importante, pronto se demostró que no era del todo correcto.
El trabajo de Thomson abrió la puerta a una serie de investigaciones que profundizarían aún más en la estructura atómica. Su descubrimiento del electrón planteó nuevas preguntas: ¿cómo se organizan estas partículas dentro del átomo? ¿Qué otras partículas existen? La ciencia estaba en un punto de inflexión, y otros científicos estaban listos para contribuir.
El Modelo Nuclear: Rutherford y la Revelación del Núcleo
Ernest Rutherford, un estudiante de Thomson, llevó la teoría atómica a un nuevo nivel. A través de su famoso experimento de dispersión de partículas alfa, descubrió que el átomo no era solo una esfera uniforme. En lugar de eso, la mayor parte de la masa del átomo se concentraba en un pequeño núcleo central, que era positivo, mientras que los electrones giraban alrededor de este núcleo. ¡Imagina un sistema solar en miniatura, donde el núcleo es el sol y los electrones son los planetas! Este descubrimiento fue fundamental y llevó a la formulación del modelo nuclear del átomo.
Rutherford no solo demostró que el átomo tenía un núcleo, sino que también sugirió que los electrones ocupaban un espacio considerable alrededor de este núcleo. Esto planteó la pregunta: ¿cómo se mantienen los electrones en órbita alrededor del núcleo, dado que tienen carga negativa y el núcleo es positivo? La respuesta a esta pregunta llevó a la siguiente gran revolución en la teoría atómica.
La Revolución Cuántica: Bohr y la Estructura Electrónica
Niels Bohr, un físico danés, entró en escena con una idea revolucionaria: el modelo de Bohr. Basándose en los trabajos de Rutherford y en los principios de la mecánica cuántica, Bohr propuso que los electrones no giraban de manera aleatoria alrededor del núcleo, sino que ocupaban niveles de energía específicos, como las capas de una cebolla. Este modelo ayudó a explicar por qué los átomos emiten y absorben luz en ciertos espectros. Imagina que los electrones son como bailarines en un escenario, cada uno en su propio nivel, realizando sus movimientos de acuerdo a la música de la energía.
La teoría de Bohr fue un gran avance, pero no estaba exenta de limitaciones. A medida que los científicos comenzaron a estudiar átomos más complejos, se dieron cuenta de que el modelo de Bohr no podía explicar todos los fenómenos observados. Esto llevó al desarrollo de la mecánica cuántica, que introdujo conceptos aún más extraños y fascinantes sobre la naturaleza de las partículas subatómicas.
La Mecánica Cuántica: Un Nuevo Paradigma
La mecánica cuántica, con figuras como Werner Heisenberg y Erwin Schrödinger, llevó la teoría atómica a un nuevo nivel de complejidad. En lugar de visualizar los electrones como pequeñas partículas en órbita, la mecánica cuántica nos enseñó que debemos pensar en ellos como ondas de probabilidad. El principio de incertidumbre de Heisenberg, por ejemplo, nos dice que no podemos conocer simultáneamente la posición y la velocidad de un electrón con precisión. Es como tratar de seguir a un pez en un acuario: a veces parece que está en un lugar, pero en realidad, está en un estado de movimiento constante.
El modelo cuántico del átomo también introdujo la idea de orbitales, que son regiones donde es más probable encontrar un electrón. En lugar de tener trayectorias definidas, los electrones se comportan como nubes de probabilidad. Esta idea es difícil de visualizar, pero es crucial para entender cómo funcionan los átomos y cómo interactúan entre sí. La mecánica cuántica nos ha permitido no solo comprender mejor el átomo, sino también desarrollar tecnologías modernas como la electrónica y la computación cuántica.
Contribuciones Modernas y Aplicaciones Prácticas
Hoy en día, la teoría atómica sigue evolucionando y expandiéndose. La investigación en física de partículas ha llevado al descubrimiento de muchas otras partículas subatómicas, como quarks y gluones, que componen los protones y neutrones del núcleo. Además, el desarrollo de la espectroscopia y la microscopía electrónica ha permitido a los científicos observar átomos y moléculas en niveles sin precedentes.
Las aplicaciones prácticas de la teoría atómica son vastas y variadas. Desde la medicina nuclear, que utiliza isótopos radiactivos para diagnóstico y tratamiento, hasta la energía nuclear, que aprovecha la fisión y fusión de núcleos atómicos para generar electricidad. Además, la comprensión de la estructura atómica ha sido fundamental en la química, la biología y la ciencia de materiales. ¡Imagina un mundo sin la teoría atómica! Sería como vivir en un rompecabezas incompleto, donde no podemos entender cómo encajan las piezas.
Reflexiones Finales: La Ciencia en Constante Evolución
La historia del desarrollo de la teoría atómica es un testimonio del ingenio humano y de nuestra búsqueda interminable de conocimiento. Cada descubrimiento ha sido como una pieza de un rompecabezas que, al unirse, nos ha permitido ver una imagen más clara del universo. A medida que avanzamos, es emocionante pensar en lo que aún nos espera. La ciencia nunca se detiene; siempre hay nuevas preguntas que hacer y nuevos caminos por explorar.
Entonces, ¿qué nos depara el futuro? ¿Seremos capaces de desentrañar los misterios del universo a un nivel aún más profundo? Solo el tiempo lo dirá. Pero una cosa es segura: la curiosidad humana y la pasión por descubrir seguirán impulsando el desarrollo de la ciencia y la teoría atómica.
Preguntas Frecuentes
1. ¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesto por un núcleo central que contiene protones y neutrones, rodeado por electrones que orbitan alrededor de él.
2. ¿Quiénes fueron los pioneros en la teoría atómica?
Los pioneros incluyen a filósofos griegos como Demócrito, químicos como John Dalton, J.J. Thomson, Ernest Rutherford y Niels Bohr, así como físicos cuánticos como Werner Heisenberg y Erwin Schrödinger.
3. ¿Cómo ha cambiado la teoría atómica a lo largo del tiempo?
La teoría atómica ha evolucionado desde la idea de partículas indivisibles en la antigua Grecia, hasta modelos complejos que incorporan la mecánica cuántica y la comprensión de partículas subatómicas.
4. ¿Cuáles son las aplicaciones prácticas de la teoría atómica?
Las aplicaciones incluyen la medicina nuclear, la energía nuclear, la química, la biología y tecnologías modernas como la electrónica y la computación cuántica.
5. ¿Por qué es importante estudiar la teoría atómica?
Estudiar la teoría atómica es fundamental para comprender la materia, la energía y los procesos que dan forma a nuestro universo, lo que a su vez tiene implicaciones en diversas áreas de la ciencia y la tecnología.