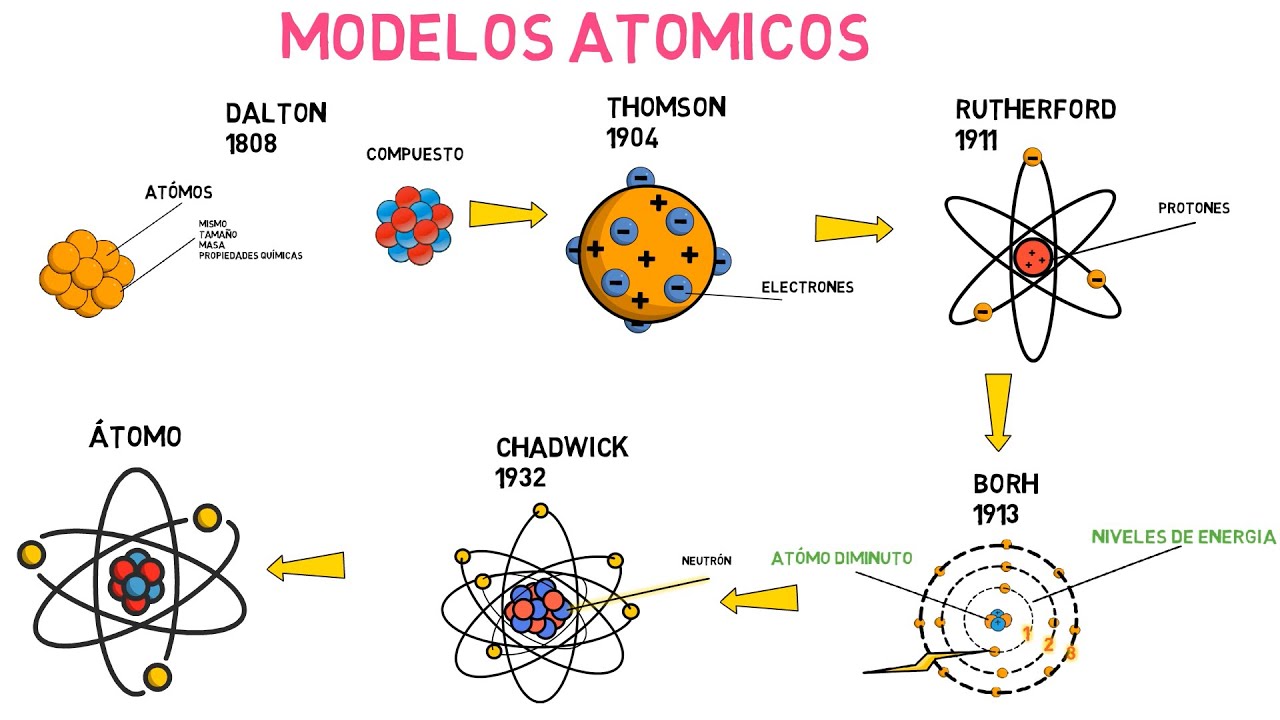
Dalton, Thomson, Rutherford y Bohr: La Evolución de la Teoría Atómica
Un Viaje a Través de la Historia Atómica
La historia de la teoría atómica es como un emocionante viaje en montaña rusa, lleno de giros y sorpresas. Desde que John Dalton propuso la idea de que todo está hecho de pequeñas partículas llamadas átomos, hasta que Niels Bohr nos llevó a un nuevo nivel de comprensión con su modelo atómico, hemos recorrido un largo camino. Cada uno de estos científicos no solo contribuyó con sus ideas, sino que también desafió las creencias existentes, empujando los límites del conocimiento humano. Pero, ¿cómo llegaron a sus conclusiones? ¿Qué les inspiró a seguir adelante cuando las cosas se volvían complicadas? ¡Vamos a descubrirlo!
El Comienzo: John Dalton y la Teoría Atómica Moderna
Comencemos nuestro viaje en el siglo XIX, donde encontramos a John Dalton, un hombre que se convirtió en el padre de la teoría atómica moderna. En 1803, Dalton presentó su modelo, que se basaba en la idea de que los átomos son esferas indivisibles y que cada elemento tiene átomos únicos. Imagina una caja de herramientas; cada herramienta es un elemento diferente, y cada una tiene su propia forma y función. Dalton sostenía que los átomos de un mismo elemento eran idénticos en masa y propiedades, lo que sentó las bases para entender la química de una manera más sistemática.
Las Leyes de Dalton
Dalton no solo se quedó con la idea de los átomos. También formuló varias leyes que fueron fundamentales para la química, como la ley de conservación de la masa y la ley de proporciones múltiples. La primera establece que la masa total de un sistema cerrado permanece constante, mientras que la segunda dice que cuando dos elementos se combinan para formar más de un compuesto, la razón en masa de uno de los elementos se puede expresar como una relación de números enteros simples. Estas leyes fueron como los cimientos de una casa, sosteniendo todo lo que vendría después en el mundo de la química.
El Descubrimiento de los Electrones: J.J. Thomson
Avancemos unas décadas hasta 1897, cuando un joven físico británico llamado J.J. Thomson hizo un descubrimiento que cambiaría para siempre nuestra comprensión de la materia. Durante sus experimentos con tubos de rayos catódicos, Thomson notó que los rayos eran desviados por campos eléctricos y magnéticos, lo que lo llevó a la conclusión de que existían partículas más pequeñas que los átomos: ¡los electrones! Imagina que los átomos son planetas en un sistema solar, y los electrones son los pequeños satélites que giran a su alrededor. Thomson propuso el modelo del «pudín de ciruelas», donde los electrones estaban incrustados en una esfera de carga positiva, como las ciruelas en un pudín. Este modelo fue revolucionario, pero, como veremos, no duró mucho.
La Teoría de Thomson en Contexto
Thomson no solo descubrió los electrones, sino que también desafió la noción de que los átomos eran indivisibles. Su trabajo abrió la puerta a una nueva comprensión de la estructura atómica. Sin embargo, aunque su modelo fue innovador, no explicaba algunas observaciones experimentales, lo que llevó a otros científicos a buscar una teoría más precisa. ¿Te imaginas estar en su lugar? Después de todo, un descubrimiento tan monumental como el de Thomson podría haber hecho que se sintiera en la cima del mundo, solo para darse cuenta de que su modelo necesitaba ajustes. Esa es la belleza de la ciencia: siempre está evolucionando.
Rutherford y el Núcleo Atómico
Pasemos ahora a 1911, donde el físico neozelandés Ernest Rutherford, conocido como el «padre de la física nuclear», realizó un experimento que lo llevaría a descubrir el núcleo atómico. En su famoso experimento de la lámina de oro, disparó partículas alfa contra una delgada lámina de oro y observó cómo algunas de ellas se desviaban en ángulos inesperados. ¿Qué significaba esto? Rutherford concluyó que los átomos tienen un núcleo denso y positivo en el centro, rodeado de electrones que orbitan a su alrededor, como un sistema solar en miniatura. Este descubrimiento fue como quitar la tapa de una olla a presión; reveló una nueva dimensión de la estructura atómica que nadie había imaginado antes.
El Modelo Planetario de Rutherford
El modelo de Rutherford cambió las reglas del juego. En lugar de un «pudín» homogéneo, ahora teníamos un núcleo central con electrones orbitando a su alrededor, lo que hizo que la comunidad científica se emocionara. Pero, al igual que con Thomson, este modelo también tenía sus limitaciones. La física clásica no podía explicar cómo los electrones podían orbitar sin perder energía y caer en el núcleo. Era como si tuvieras un coche en una carretera, pero no pudieras encontrar el freno. ¡Era hora de un nuevo héroe!
Niels Bohr y la Cuantización de la Energía
Entra Niels Bohr, un físico danés que se unió a la fiesta en 1913. Bohr tomó el modelo de Rutherford y lo refinó, introduciendo la idea de que los electrones solo podían ocupar ciertas órbitas permitidas y que, al hacerlo, no emitían energía. Este concepto se conoció como la cuantización de la energía. Imagina que los electrones son bailarines en un escenario; solo pueden moverse en ciertas áreas del escenario sin caer. Cuando un electrón salta de una órbita a otra, absorbe o emite energía en forma de fotones. Este modelo no solo resolvió el misterio de la estabilidad de los electrones, sino que también proporcionó una base sólida para la teoría cuántica.
Las Implicaciones del Modelo de Bohr
El modelo de Bohr fue un gran avance y explicó muchas de las propiedades de los átomos de hidrógeno. Sin embargo, a medida que los científicos comenzaron a estudiar elementos más complejos, se dieron cuenta de que el modelo de Bohr no podía explicar completamente sus comportamientos. Así que, como un rompecabezas, la teoría atómica continuó evolucionando, con nuevos científicos aportando sus ideas y refinando el conocimiento existente. La ciencia, después de todo, es un proceso colaborativo, y cada descubrimiento se construye sobre los hombros de los gigantes que vinieron antes.
La Teoría Cuántica y Más Allá
Después de Bohr, la teoría cuántica tomó el relevo. Científicos como Werner Heisenberg y Erwin Schrödinger aportaron nuevas ideas que revolucionaron aún más nuestra comprensión del átomo. Heisenberg, con su principio de incertidumbre, nos mostró que no podemos conocer simultáneamente la posición y el momento de una partícula. Por otro lado, Schrödinger introdujo la ecuación de onda, que describe cómo las partículas cuánticas se comportan como ondas. ¡Vaya giro! La imagen del átomo se volvió aún más compleja y fascinante.
Un Futuro Brillante para la Teoría Atómica
Hoy en día, la teoría atómica es fundamental en muchos campos de la ciencia, desde la química hasta la física de partículas y la nanotecnología. A medida que la tecnología avanza, también lo hace nuestra capacidad para explorar y manipular átomos y moléculas. ¿Te imaginas un futuro donde podamos construir materiales atómicamente precisos o manipular estructuras a nivel cuántico? La ciencia ficción podría convertirse en realidad, todo gracias a los pioneros como Dalton, Thomson, Rutherford y Bohr.
Preguntas Frecuentes
¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesto por un núcleo denso que contiene protones y neutrones, rodeado por electrones que orbitan en diferentes niveles de energía.
¿Cómo se descubrieron los electrones?
Los electrones fueron descubiertos por J.J. Thomson en 1897 a través de experimentos con tubos de rayos catódicos, donde observó que los rayos eran desviados por campos eléctricos y magnéticos.
¿Cuál es el modelo atómico más aceptado hoy en día?
Hoy en día, el modelo cuántico es el más aceptado, que describe los electrones como ondas de probabilidad en lugar de partículas definidas, gracias a los avances de científicos como Schrödinger y Heisenberg.
¿Qué implicaciones tiene la teoría atómica en la vida cotidiana?
La teoría atómica tiene implicaciones en múltiples aspectos de la vida cotidiana, desde la química que se utiliza en la cocina hasta la medicina y la tecnología moderna, como los semiconductores y los materiales avanzados.
¿Quién fue el primero en proponer la idea de los átomos?
La idea de que la materia está compuesta por átomos se remonta a la antigua Grecia, pero John Dalton fue el primero en desarrollar la teoría atómica moderna en el siglo XIX.