¿Cuáles son los Subniveles de Energía? Descubre su Importancia en la Química
Entendiendo la Estructura Electrónica
¿Alguna vez te has preguntado cómo los electrones se organizan en un átomo? Imagina que el átomo es como un edificio de apartamentos. Cada apartamento tiene un número limitado de inquilinos, que en este caso son los electrones. La forma en que estos electrones se distribuyen en los distintos niveles y subniveles de energía es fundamental para entender cómo se comportan los elementos en las reacciones químicas. Así que, ¿qué son exactamente esos subniveles de energía y por qué son tan importantes en la química? Vamos a desglosarlo.
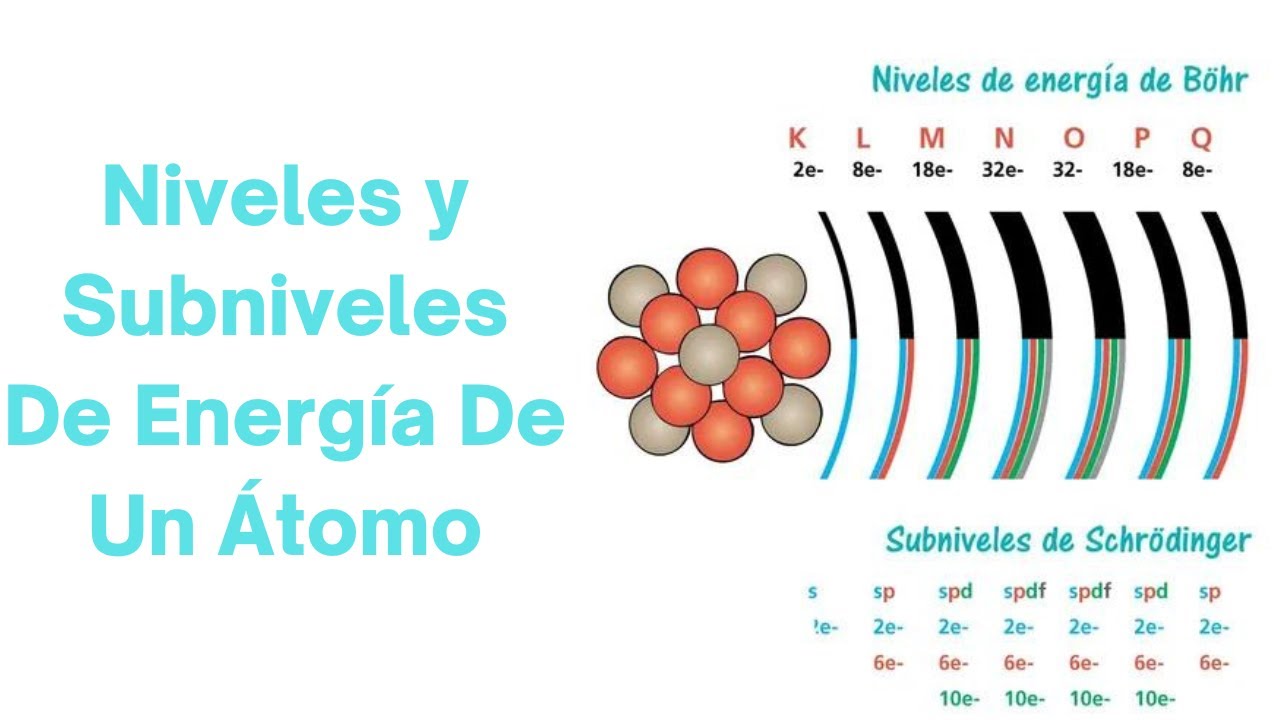
La química es una ciencia fascinante que estudia la materia y sus transformaciones. En el corazón de la química se encuentra la estructura atómica, que nos dice cómo están organizados los átomos. Los subniveles de energía son parte de este entramado. Se dividen en diferentes tipos, como s, p, d y f, y cada uno tiene características únicas. Piensa en ellos como diferentes pisos en nuestro edificio de apartamentos: cada piso tiene su propio conjunto de reglas y capacidades.
Los Niveles de Energía y su Organización
Los niveles de energía en un átomo se representan con números cuánticos, que son como las direcciones de nuestros apartamentos. El primer número, el número cuántico principal (n), indica el nivel de energía, mientras que los subniveles (l) nos dicen la forma y la orientación de la región donde se encuentran los electrones. Por ejemplo, el nivel de energía más bajo, n=1, tiene solo un subnivel (s), mientras que el nivel n=2 tiene dos subniveles (s y p).
Subniveles de Energía: S, P, D y F
Cada subnivel tiene su propia capacidad para albergar electrones. El subnivel s puede contener hasta 2 electrones, el p hasta 6, el d hasta 10 y el f hasta 14. ¿Te imaginas un edificio donde algunos pisos son más grandes que otros? Así es como funciona. Este arreglo no solo determina cuántos electrones puede tener un átomo, sino que también influye en su comportamiento químico.
Por ejemplo, los elementos que se encuentran en la misma columna de la tabla periódica tienen configuraciones electrónicas similares en sus subniveles. Esto significa que reaccionan de manera parecida. Por eso, la química se basa tanto en la estructura atómica. Los subniveles de energía nos ayudan a predecir cómo se comportará un elemento en una reacción química, casi como si tuviéramos una bola de cristal.
La Importancia de los Subniveles en las Reacciones Químicas
Cuando los átomos interactúan, lo hacen a través de sus electrones más externos, que son los que se encuentran en los subniveles más altos. Estos electrones son cruciales para formar enlaces químicos, que son las conexiones entre los átomos. Así que, si entiendes cómo se distribuyen los electrones en los subniveles de energía, puedes tener una mejor idea de cómo se comportarán los elementos en diferentes situaciones.
Ejemplos de Comportamiento Químico Basado en Subniveles
Tomemos el ejemplo del oxígeno y el flúor. Ambos elementos son muy reactivos, pero tienen configuraciones electrónicas diferentes en sus subniveles. El oxígeno tiene una configuración de 1s² 2s² 2p⁴, mientras que el flúor tiene 1s² 2s² 2p⁵. La diferencia en sus electrones de valencia (los electrones en el nivel más alto) explica por qué el flúor es más reactivo que el oxígeno. Es como si el flúor estuviera «hambriento» de electrones, mientras que el oxígeno está más «satisfecho».
Los Principios de la Configuración Electrónica
La configuración electrónica es la forma en que se distribuyen los electrones en los subniveles. Hay reglas que nos ayudan a determinar cómo se llenan estos subniveles. Dos de las más importantes son el principio de exclusión de Pauli y la regla de Hund.
Principio de Exclusión de Pauli
Este principio establece que no puede haber dos electrones en un átomo que tengan los mismos cuatro números cuánticos. En otras palabras, si un electrón ocupa un espacio en un subnivel, el siguiente electrón que quiera entrar en ese mismo subnivel tendrá que tener un spin opuesto. Es como si en un apartamento solo pudiera haber una persona durmiendo en la cama: si alguien más quiere entrar, tendrá que dormir en el sofá.
Regla de Hund
La regla de Hund dice que cuando los electrones se distribuyen en subniveles con más de un orbital (como el subnivel p o d), se distribuyen primero en orbitales vacíos antes de emparejarse. Imagina que estás en una sala de cine: si hay varios asientos vacíos, todos los amigos se sentarían en asientos separados antes de que algunos se vean obligados a compartir. Esta regla es crucial para entender cómo se forman los enlaces químicos y la estabilidad de los átomos.
Aplicaciones Prácticas de los Subniveles de Energía
La comprensión de los subniveles de energía no es solo teoría; tiene aplicaciones prácticas en diversos campos. Desde la medicina hasta la ingeniería, el conocimiento sobre cómo los electrones se organizan puede marcar la diferencia.
En la Medicina
La química farmacéutica se basa en la comprensión de las interacciones a nivel atómico. Por ejemplo, al diseñar un nuevo fármaco, los científicos deben considerar cómo los electrones en diferentes subniveles influirán en la forma en que el fármaco se une a su objetivo en el cuerpo. Si se ignoran estas interacciones, el fármaco podría no funcionar como se espera.
En la Ingeniería de Materiales
En la ingeniería de materiales, los subniveles de energía son igualmente cruciales. Los ingenieros deben entender cómo se comportan los electrones en diferentes materiales para diseñar componentes más eficientes y duraderos. Por ejemplo, en la creación de semiconductores, la disposición de los electrones en los subniveles determina cómo se comporta el material frente a la electricidad.
Preguntas Frecuentes
1. ¿Qué son los subniveles de energía?
Los subniveles de energía son divisiones dentro de los niveles de energía en un átomo que describen cómo se distribuyen los electrones. Se clasifican en s, p, d y f, cada uno con diferentes capacidades para albergar electrones.
2. ¿Por qué son importantes los subniveles de energía en la química?
Son importantes porque determinan cómo se comportan los átomos en las reacciones químicas. Los electrones en los subniveles más externos son los que participan en la formación de enlaces químicos.
3. ¿Cómo se determina la configuración electrónica de un átomo?
La configuración electrónica se determina siguiendo reglas como el principio de exclusión de Pauli y la regla de Hund, que indican cómo se distribuyen los electrones en los subniveles.
4. ¿Cómo influyen los subniveles de energía en la reactividad de los elementos?
Los subniveles de energía influyen en la reactividad porque los electrones de valencia (en los subniveles más altos) son los que participan en la formación de enlaces. La disposición de estos electrones determina cuán propenso es un elemento a reaccionar con otros.
5. ¿Pueden los subniveles de energía afectar la estabilidad de un átomo?
Sí, la estabilidad de un átomo está directamente relacionada con la configuración de sus electrones en los subniveles. Un átomo con una configuración completa en sus subniveles es generalmente más estable y menos reactivo.
Así que, la próxima vez que pienses en los átomos y su estructura, recuerda que los subniveles de energía son una pieza clave del rompecabezas. No solo nos ayudan a entender la química, sino que también tienen aplicaciones prácticas que impactan nuestra vida cotidiana. ¿No es fascinante cómo algo tan pequeño puede tener un impacto tan grande? ¡Explorar el mundo de los átomos es una aventura que nunca termina!