Conclusión de los Modelos Atómicos: Un Análisis Completo de la Evolución de la Teoría Atómica
Un Viaje a Través del Tiempo: Desde Demócrito hasta la Mecánica Cuántica
La historia de los modelos atómicos es como un emocionante viaje en el tiempo, lleno de descubrimientos, teorías desafiadas y avances que nos han llevado a comprender el universo a un nivel profundamente íntimo. Desde la antigua Grecia, donde el filósofo Demócrito propuso la idea de que todo estaba compuesto por pequeñas partículas indivisibles llamadas átomos, hasta la complejidad de la mecánica cuántica del siglo XX, cada modelo ha sido un peldaño hacia la comprensión actual de la materia. A lo largo de este artículo, vamos a desglosar cómo ha evolucionado nuestra visión del átomo, cómo cada teoría ha aportado algo único y por qué es crucial entender este viaje en el contexto de la ciencia moderna.
Imagina por un momento que estás en un cine, observando una película que narra la historia del átomo. Al principio, ves un modelo simple, casi primitivo, donde los átomos son esferas sólidas. A medida que avanza la trama, la ciencia avanza, y el átomo se transforma en algo más complicado, lleno de electrones, protones y neutrones danzando en un escenario cuántico. ¿Te has preguntado alguna vez cómo llegamos a esta complejidad? A continuación, exploraremos las distintas etapas de esta historia fascinante, desde los primeros modelos hasta las teorías contemporáneas que desafían nuestra percepción de la realidad.
Los Primeros Pasos: Demócrito y el Concepto de Átomo
El viaje comienza en la antigua Grecia, donde el filósofo Demócrito lanzó la idea de que todo en el universo estaba compuesto por pequeñas partículas indivisibles. Aunque su teoría no contaba con la validación experimental que tenemos hoy, su idea fue revolucionaria para su tiempo. Imagina un rompecabezas: Demócrito propuso que, si quitamos todas las piezas, lo que quedaría serían los átomos, que no se pueden dividir más. Este concepto, aunque rudimentario, sentó las bases para futuros científicos que se aventurarían a explorar más allá de lo visible.
Aristóteles y la Reacción a la Teoría Atómica
Sin embargo, no todo el mundo estaba de acuerdo. Aristóteles, otro gran pensador griego, desestimó la idea de los átomos y propuso que todo estaba compuesto por cuatro elementos: tierra, aire, fuego y agua. Este punto de vista dominó durante siglos, y la teoría atómica de Demócrito fue prácticamente olvidada. Es como si en una película de ciencia ficción, la idea de los átomos se hubiera convertido en un mito, una historia que nadie quería creer. Pero, como en toda buena historia, el regreso triunfal estaba por llegar.
El Renacimiento y el Resurgimiento de la Teoría Atómica
Con el advenimiento del Renacimiento, la ciencia comenzó a florecer nuevamente. En el siglo XVII, científicos como Robert Boyle empezaron a cuestionar las teorías anteriores y a realizar experimentos que sentarían las bases de la química moderna. Boyle, con su famoso trabajo «El Esplendor de la Química», propuso que los gases se comportan de manera predecible y que la materia puede ser descompuesta en elementos más simples. ¡Aquí es donde la historia del átomo empieza a cobrar vida nuevamente!
Dalton y la Teoría Atómica Moderna
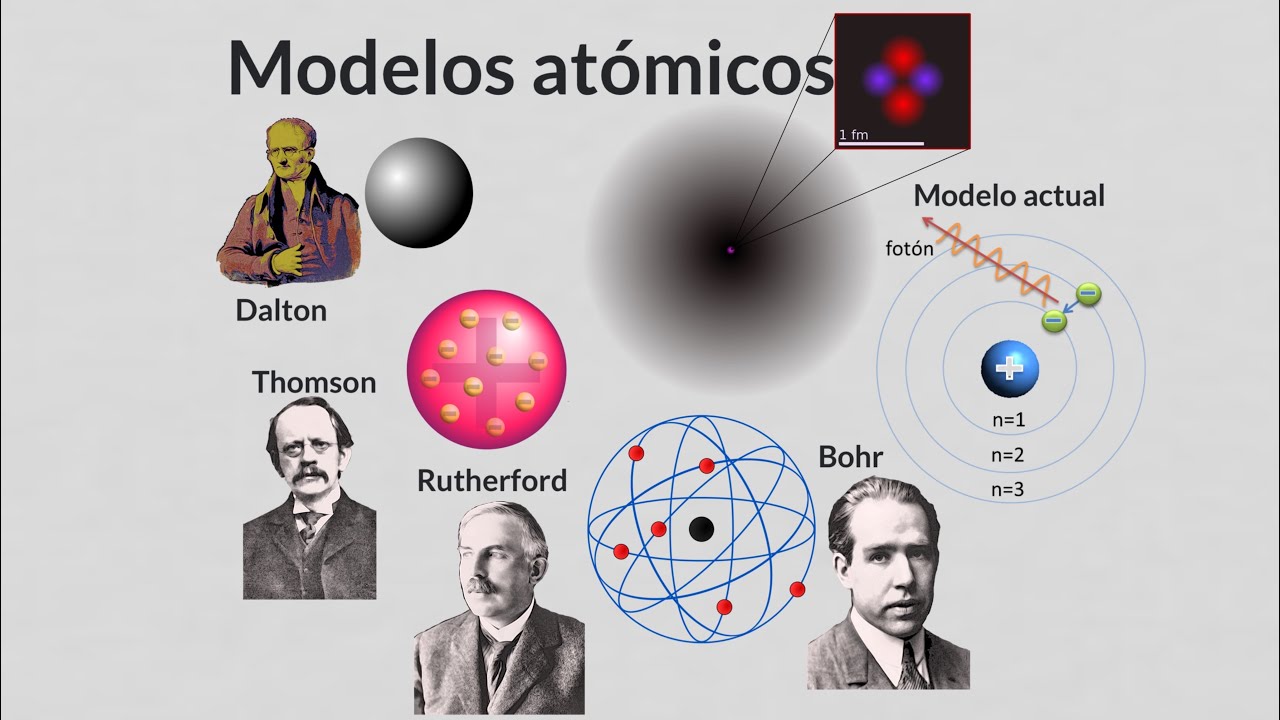
Luego llegamos a John Dalton en el siglo XIX, quien formuló la primera teoría atómica moderna. Dalton, con su enfoque científico y su pasión por la química, propuso que cada elemento está compuesto por átomos de un tipo específico, que se combinan en proporciones fijas para formar compuestos. Imagínate una receta: los átomos son los ingredientes que, al combinarse de ciertas maneras, crean todo lo que conocemos. Esta teoría fue fundamental para entender la composición de la materia y marcó un hito en la historia de la química.
El Descubrimiento del Electrón: Thomson y el Modelo del Pudín de Ciruelas
En 1897, J.J. Thomson hizo un descubrimiento que cambiaría el juego: el electrón. Al estudiar los rayos catódicos, Thomson concluyó que los átomos no eran indivisibles, como se pensaba, sino que contenían partículas más pequeñas. Su modelo del átomo, conocido como el «modelo del pudín de ciruelas», imaginaba el átomo como una esfera cargada positivamente con electrones incrustados en ella, como ciruelas en un pudín. ¡Qué imagen tan deliciosa! Pero, como toda buena historia, este modelo pronto sería desafiado.
Rutherford y el Modelo Planetario
En 1911, Ernest Rutherford llevó la historia en una nueva dirección. A través de su famoso experimento de dispersión de partículas alfa, demostró que el átomo tiene un núcleo denso y positivo rodeado por electrones que orbitan a su alrededor, similar a cómo los planetas orbitan alrededor del sol. Este modelo planetario era una representación más precisa de la estructura atómica, y los científicos comenzaron a imaginar el átomo como un pequeño sistema solar. ¡Es asombroso pensar en lo pequeños que son estos átomos y en cómo, a pesar de su tamaño, tienen una estructura tan compleja!
La Mecánica Cuántica: Un Nuevo Paradigma
Con el avance de la ciencia, el modelo de Rutherford no podía explicar completamente el comportamiento de los electrones. Aquí es donde entra en juego la mecánica cuántica, que revolucionó nuestra comprensión del átomo en el siglo XX. Científicos como Niels Bohr y posteriormente Erwin Schrödinger propusieron que los electrones no se mueven en órbitas fijas, sino que existen en «nubes de probabilidad». ¿Qué significa esto? En lugar de saber exactamente dónde está un electrón, podemos calcular la probabilidad de encontrarlo en un lugar determinado, como si estuvieras buscando un gato escondido en una habitación. ¡Esto es un cambio de juego total!
El Modelo Cuántico: Una Revolución en la Comprensión Atómica
El modelo cuántico nos llevó a una comprensión más profunda de la estructura atómica, incorporando conceptos como la dualidad onda-partícula y el principio de incertidumbre de Heisenberg. La idea de que las partículas pueden comportarse como ondas es fascinante y desconcertante a la vez. Imagínate un grupo de bailarines que, en lugar de moverse en una coreografía fija, cambian de forma y se desplazan en patrones impredecibles. Así es como los electrones se comportan en el mundo cuántico.
La Teoría Cuántica y sus Implicaciones Modernas
Hoy en día, la teoría cuántica es fundamental para la física moderna y tiene aplicaciones en tecnología, desde la computación cuántica hasta la medicina. Pero, ¿cómo afecta esto a nuestra vida diaria? Imagina que la próxima vez que uses tu teléfono móvil, estés utilizando principios que antes solo existían en el ámbito de la teoría. ¡Es increíble pensar en cómo la ciencia ha evolucionado para influir en nuestro mundo cotidiano!
El Futuro de la Teoría Atómica
A medida que seguimos explorando el mundo atómico, nuevas preguntas surgen. ¿Qué más hay allá de lo que conocemos? La investigación en física de partículas y la búsqueda de nuevas teorías, como la teoría de cuerdas, continúan empujando los límites de nuestra comprensión. El futuro de la teoría atómica es tan emocionante como su pasado, y cada descubrimiento abre nuevas puertas a lo desconocido. Es como una serie de televisión que nunca termina, siempre dejando a los espectadores con ganas de más.
Reflexiones Finales
La evolución de los modelos atómicos es un testimonio de la curiosidad humana y la búsqueda del conocimiento. Desde los antiguos filósofos griegos hasta los científicos contemporáneos, cada paso en este viaje ha sido crucial para moldear nuestra comprensión del universo. A medida que seguimos explorando, nos damos cuenta de que, aunque hemos avanzado mucho, todavía queda mucho por descubrir. Así que, ¿qué opinas tú? ¿Crees que hemos llegado al final de nuestra comprensión sobre el átomo, o aún hay más sorpresas esperando ser reveladas?
Preguntas Frecuentes
¿Quién fue el primero en proponer la idea de los átomos?
La idea de los átomos fue propuesta por el filósofo griego Demócrito en la antigua Grecia, aunque no fue hasta siglos después que se desarrolló la teoría atómica moderna.
¿Cuál es la diferencia entre el modelo de Rutherford y el modelo de Bohr?
El modelo de Rutherford describía el átomo como un núcleo denso con electrones orbitando a su alrededor, mientras que el modelo de Bohr introdujo niveles de energía específicos para los electrones, sugiriendo que solo pueden existir en ciertas órbitas estables.
¿Qué es la mecánica cuántica y por qué es importante?
La mecánica cuántica es una rama de la física que estudia el comportamiento de las partículas a nivel subatómico. Es importante porque ha revolucionado nuestra comprensión de la materia y ha llevado a avances tecnológicos significativos.
¿Cómo afecta la teoría atómica a la tecnología moderna?
La teoría atómica es fundamental para el desarrollo de tecnologías como la computación cuántica, la resonancia magnética en medicina y muchos otros campos que dependen de nuestra comprensión de la materia a nivel atómico.
¿Qué descubrimientos futuros se esperan en la teoría atómica?
A medida que la investigación continúa, se esperan descubrimientos sobre la naturaleza de la materia oscura, la antimateria y nuevas teorías que podrían cambiar nuestra comprensión del universo, como la teoría de cuerdas.