¿Qué es la Afinidad Electrónica? Definición, Importancia y Ejemplos Explicados
Un Vistazo General a la Afinidad Electrónica
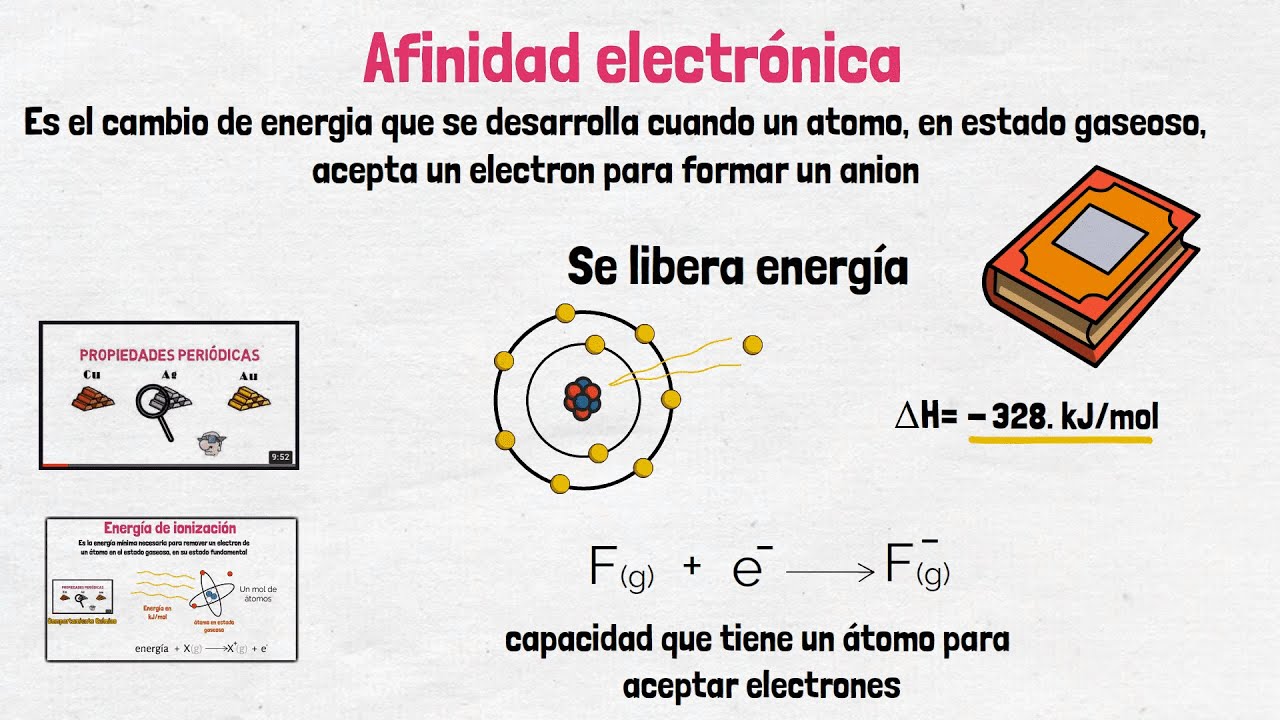
La afinidad electrónica es un concepto fascinante en la química que se refiere a la cantidad de energía liberada o absorbida cuando un átomo en estado gaseoso captura un electrón. Imagina que el átomo es como un imán, y el electrón es un pequeño objeto metálico. Cuando el imán atrae al objeto, puede liberar energía, lo que se traduce en una especie de «felicidad» del átomo al haber ganado un electrón. Este fenómeno no solo es crucial para entender cómo se forman los enlaces químicos, sino que también tiene implicaciones importantes en diversas áreas, desde la biología hasta la física. Pero, ¿por qué debería importarte esto? Porque la afinidad electrónica juega un papel fundamental en la reactividad de los elementos, y comprenderla puede ayudarte a entender mejor el mundo que te rodea.
Ahora bien, ¿cómo se mide la afinidad electrónica? Generalmente, se expresa en electronvoltios (eV) o kilojulios por mol (kJ/mol). La mayoría de los elementos tienen una afinidad electrónica positiva, lo que significa que liberan energía cuando capturan un electrón. Sin embargo, hay excepciones, y eso es lo que hace que este tema sea aún más intrigante. La tabla periódica es como un mapa del tesoro que nos ayuda a entender las tendencias de la afinidad electrónica entre los diferentes elementos. Por ejemplo, los halógenos, como el flúor y el cloro, tienen una alta afinidad electrónica, mientras que los gases nobles, como el helio y el neón, tienen una afinidad casi nula. ¿Te has preguntado alguna vez por qué algunos elementos parecen ser más «hambrientos» de electrones que otros? La respuesta está en su estructura atómica y en la forma en que interactúan con su entorno.
La Importancia de la Afinidad Electrónica en la Química
La afinidad electrónica no es solo un concepto teórico; tiene aplicaciones prácticas en el mundo real. Por ejemplo, en la formación de compuestos químicos, la afinidad electrónica influye en la estabilidad de los enlaces que se forman. Cuando un átomo gana un electrón, puede convertirse en un ion negativo, lo que a su vez puede llevar a la formación de enlaces iónicos con otros átomos que han perdido electrones. Esto es esencial en la química de los compuestos iónicos, como la sal de mesa (NaCl), donde el sodio (Na) pierde un electrón y el cloro (Cl) lo gana. La energía liberada durante este proceso es lo que hace que la sal sea estable.
Además, la afinidad electrónica es clave para entender fenómenos biológicos. Por ejemplo, en la respiración celular, las moléculas de oxígeno tienen una alta afinidad electrónica, lo que les permite captar electrones de otras moléculas y participar en reacciones químicas que producen energía. Esta energía es vital para el funcionamiento de nuestras células. Así que, la próxima vez que respires, recuerda que la afinidad electrónica está trabajando arduamente para mantenerte vivo.
Ejemplos de Afinidad Electrónica en Acción
1. Los Halógenos: Los «Atraídos» por los Electrones
Hablemos de los halógenos, esos elementos que parecen tener una obsesión por los electrones. El flúor, por ejemplo, tiene una de las afinidades electrónicas más altas de la tabla periódica. Cuando un átomo de flúor se encuentra con un electrón, es como si un niño se encontrara con su juguete favorito. El flúor libera una gran cantidad de energía al capturar ese electrón, lo que lo convierte en un ion negativo altamente estable. Este comportamiento es el motivo por el que el flúor es tan reactivo y forma compuestos con facilidad, como el famoso ácido fluorhídrico (HF).
2. Los Gases Nobles: La Excepción a la Regla
Por otro lado, tenemos a los gases nobles, esos elementos que parecen tener todo bajo control. Helio, neón y argón son ejemplos de gases nobles que tienen una afinidad electrónica casi nula. ¿Por qué? Porque ya tienen una capa de electrones completa y no sienten la necesidad de ganar más. Es como si estuvieran en una fiesta y decidieran no interactuar con nadie. Esto los hace muy estables y poco reactivos. Así que, si alguna vez te has preguntado por qué el helio no forma compuestos, ahora lo sabes: simplemente no necesita más electrones.
Tendencias en la Afinidad Electrónica a Través de la Tabla Periódica
Al observar la tabla periódica, es interesante notar que la afinidad electrónica no es uniforme. Por lo general, aumenta de izquierda a derecha y disminuye de arriba hacia abajo. Esto significa que los elementos en la parte superior derecha de la tabla, como el flúor, tienen una alta afinidad electrónica, mientras que los elementos en la parte inferior izquierda, como el litio, tienen una afinidad mucho más baja. ¿Por qué sucede esto? Bueno, a medida que nos movemos hacia la derecha, los átomos tienen más protones en su núcleo, lo que crea una mayor atracción por los electrones adicionales. Sin embargo, a medida que bajamos en la tabla, las capas adicionales de electrones hacen que la atracción disminuya, ya que los electrones exteriores están más alejados del núcleo.
La Influencia de la Estructura Atómica
La estructura atómica juega un papel crucial en la afinidad electrónica. Los elementos con electrones de valencia más cercanos al núcleo tienden a tener una mayor afinidad. Por ejemplo, el oxígeno, que tiene seis electrones de valencia, está muy interesado en captar un electrón adicional para completar su capa, lo que resulta en una afinidad electrónica significativa. En contraste, los metales de transición, que a menudo tienen electrones d en capas más internas, tienden a tener afinidades electrónicas más bajas. La complejidad de la estructura atómica es como un rompecabezas que nos ayuda a entender por qué algunos elementos son más «agresivos» en su búsqueda de electrones que otros.
Afinidad Electrónica y su Relación con la Electronegatividad
La electronegatividad y la afinidad electrónica están estrechamente relacionadas, aunque no son lo mismo. La electronegatividad se refiere a la capacidad de un átomo para atraer electrones en un enlace químico, mientras que la afinidad electrónica se refiere a la energía liberada o absorbida cuando un átomo captura un electrón. En términos simples, la electronegatividad es como el deseo de un átomo de atraer electrones, mientras que la afinidad electrónica es el resultado de esa atracción cuando efectivamente captura un electrón. Generalmente, los elementos con alta electronegatividad también tienen alta afinidad electrónica. Esto es evidente en los halógenos, que son altamente electronegativos y tienen una gran afinidad por los electrones.
El Papel de la Afinidad Electrónica en la Formación de Enlaces Químicos
La afinidad electrónica es fundamental en la formación de enlaces químicos. Cuando un átomo gana un electrón, se convierte en un ion negativo y puede formar un enlace iónico con un ion positivo. Por ejemplo, en el caso del cloruro de sodio (NaCl), el sodio pierde un electrón y se convierte en un ion positivo, mientras que el cloro gana ese electrón y se convierte en un ion negativo. La atracción electrostática entre estos dos iones es lo que mantiene unida la sal. Sin la afinidad electrónica, no tendríamos la variedad de compuestos químicos que forman la base de la química orgánica e inorgánica.
Aplicaciones Prácticas de la Afinidad Electrónica
La afinidad electrónica tiene muchas aplicaciones prácticas en la vida cotidiana. Desde la producción de medicamentos hasta el desarrollo de nuevas tecnologías, este concepto es esencial. Por ejemplo, en la fabricación de baterías, se aprovecha la alta afinidad electrónica de ciertos materiales para crear reacciones químicas que producen electricidad. Asimismo, en la investigación de nuevos materiales, entender la afinidad electrónica puede ayudar a los científicos a diseñar compuestos con propiedades específicas.
El Futuro de la Investigación en Afinidad Electrónica
La investigación sobre la afinidad electrónica continúa avanzando. Los científicos están explorando nuevas formas de manipular la afinidad electrónica para desarrollar tecnologías más eficientes y sostenibles. Por ejemplo, se están investigando nuevos catalizadores que aprovechan la afinidad electrónica para acelerar reacciones químicas en procesos industriales. Este tipo de innovación podría tener un impacto significativo en la reducción de la huella de carbono y en la producción de energía limpia. En resumen, la afinidad electrónica no solo es un concepto interesante, sino que también es un motor de innovación en la ciencia y la tecnología.
Preguntas Frecuentes sobre la Afinidad Electrónica
1. ¿La afinidad electrónica es la misma para todos los elementos?
No, la afinidad electrónica varía entre los diferentes elementos. Algunos elementos, como los halógenos, tienen una alta afinidad electrónica, mientras que otros, como los gases nobles, tienen una afinidad casi nula.
2. ¿Cómo afecta la afinidad electrónica a la reactividad de un elemento?
La afinidad electrónica influye en la reactividad de un elemento al determinar su capacidad para captar electrones. Los elementos con alta afinidad electrónica tienden a ser más reactivos, ya que buscan completar su capa de electrones.
3. ¿Es posible que un elemento tenga afinidad electrónica negativa?
Sí, aunque es raro, algunos elementos pueden tener afinidades electrónicas negativas, lo que significa que requieren energía para captar un electrón en lugar de liberarla.
4. ¿Por qué los gases nobles son estables?
Los gases nobles son estables porque tienen una capa de electrones completa, lo que significa que no sienten la necesidad de ganar o perder electrones. Esto los hace muy poco reactivos.
5. ¿Cómo se mide la afinidad electrónica?
La afinidad electrónica se mide en electronvoltios (eV) o kilojulios por mol (kJ/mol) y se determina a través de experimentos que miden la energía liberada o absorbida cuando un átomo captura un electrón.