Modelo de Bohr del Oxígeno: Estructura, Características y Aplicaciones
Introducción al Modelo de Bohr
El modelo de Bohr es una de esas ideas brillantes que cambiaron nuestra comprensión del átomo y la estructura atómica. Imagina un pequeño sistema solar en miniatura, donde los electrones giran alrededor del núcleo como planetas alrededor del sol. Este modelo fue propuesto por Niels Bohr en 1913 y, aunque ha evolucionado con el tiempo, su esencia sigue siendo relevante, especialmente cuando hablamos del oxígeno. En este artículo, nos adentraremos en la estructura del oxígeno desde la perspectiva del modelo de Bohr, exploraremos sus características y analizaremos sus diversas aplicaciones. Así que, ¡prepárate para un viaje fascinante al mundo de los átomos!
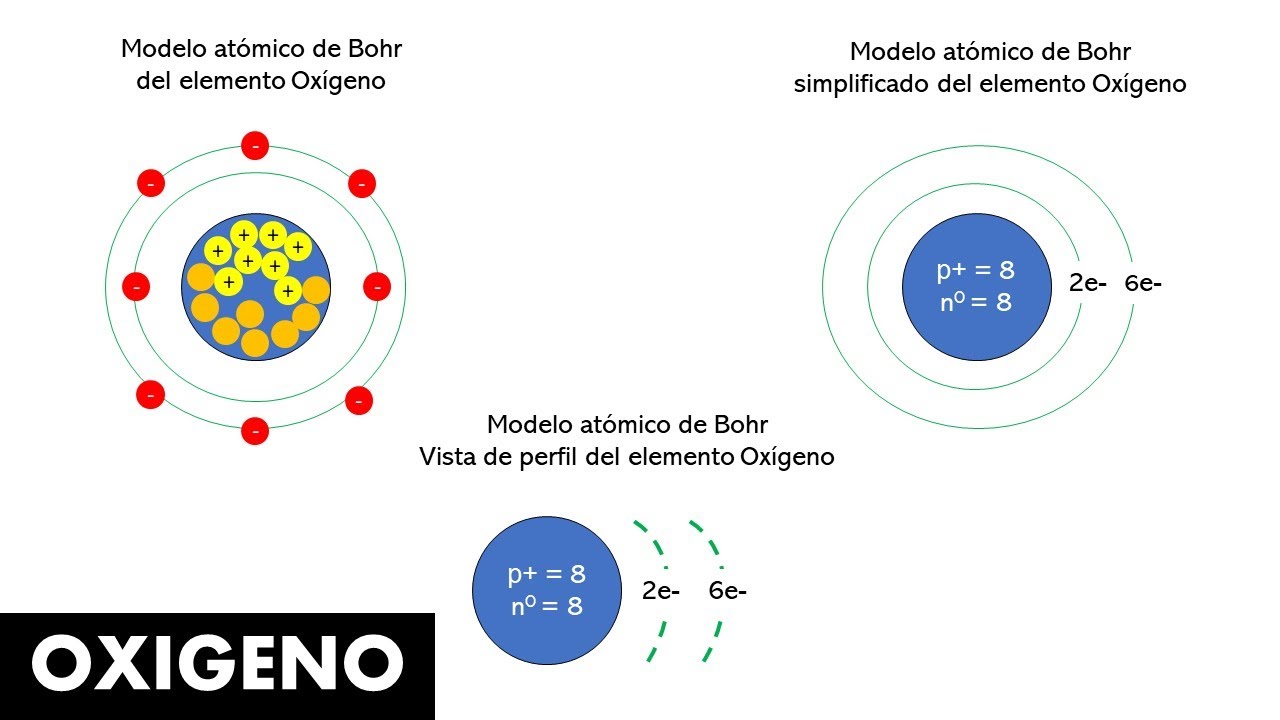
Para entender mejor cómo se aplica el modelo de Bohr al oxígeno, primero necesitamos recordar algunos conceptos básicos sobre el átomo. El oxígeno, con símbolo O y número atómico 8, es un elemento esencial para la vida. Su núcleo está compuesto por ocho protones y, en su estado más común, también tiene ocho neutrones. Pero lo que realmente nos interesa son los electrones que giran a su alrededor. Según el modelo de Bohr, estos electrones ocupan niveles de energía específicos. Así que, ¿cómo se distribuyen estos electrones en el oxígeno? En total, el oxígeno tiene ocho electrones: dos en el primer nivel de energía y seis en el segundo. Esta configuración no solo es interesante desde un punto de vista científico, sino que también nos ayuda a entender la reactividad química del oxígeno.
Estructura del Oxígeno en el Modelo de Bohr
Configuración Electrónica
La configuración electrónica del oxígeno es crucial para entender su comportamiento químico. En el modelo de Bohr, los electrones se distribuyen en niveles de energía que se asemejan a órbitas. En el caso del oxígeno, los dos primeros electrones se ubican en el primer nivel de energía (el más cercano al núcleo), mientras que los otros seis se encuentran en el segundo nivel. Esto significa que el oxígeno tiene una configuración electrónica de 1s² 2s² 2p⁴. Pero, ¿qué significa esto en términos prácticos? La clave está en la forma en que estos electrones interactúan con otros átomos.
La configuración de electrones del oxígeno lo hace altamente reactivo. Debido a que el segundo nivel de energía tiene capacidad para albergar hasta ocho electrones, el oxígeno busca “rellenar” ese nivel. Esto se traduce en su tendencia a formar enlaces químicos con otros elementos, como el hidrógeno, para crear compuestos esenciales como el agua (H₂O). Así que, en esencia, el oxígeno está siempre en busca de compañeros para completar su «círculo» de electrones.
Protones y Neutrones: El Núcleo
El núcleo del oxígeno es donde se encuentra la mayor parte de su masa. Con ocho protones y, en su forma más común, ocho neutrones, este núcleo es un centro de atracción para los electrones. Los protones, que son partículas con carga positiva, ejercen una fuerza electrostática que mantiene a los electrones en sus órbitas. Los neutrones, aunque no tienen carga, juegan un papel crucial al estabilizar el núcleo. Pero, ¿alguna vez te has preguntado por qué el oxígeno tiene una relación tan equilibrada entre protones y neutrones?
La respuesta radica en la estabilidad nuclear. La combinación de protones y neutrones ayuda a contrarrestar la repulsión entre los protones, que tienden a repelerse debido a sus cargas positivas. Esta interacción delicada es fundamental para la existencia del oxígeno como elemento estable en la naturaleza.
Características del Oxígeno en el Modelo de Bohr
Propiedades Físicas
El oxígeno es un gas incoloro e inodoro en condiciones normales. A temperaturas extremadamente bajas, se convierte en un líquido azul pálido. Pero, ¿sabías que el oxígeno es el tercer elemento más abundante en el universo? Además de ser vital para la respiración de los seres vivos, también es un componente clave de muchos compuestos. Por ejemplo, se encuentra en el agua, en los ácidos y en casi todos los organismos vivos.
Desde el punto de vista del modelo de Bohr, las propiedades físicas del oxígeno se pueden atribuir a su estructura atómica. La forma en que los electrones están organizados en niveles de energía afecta cómo interactúa el oxígeno con la luz y otros elementos. Esto también se relaciona con su capacidad para formar enlaces químicos y participar en reacciones.
Propiedades Químicas
El oxígeno es conocido por su fuerte reactividad. Puede combinarse con casi todos los elementos para formar compuestos. Esto se debe a que busca completar su nivel de energía exterior, que, como mencionamos, tiene seis electrones. Por eso, el oxígeno es un oxidante poderoso. Cuando se combina con otros elementos, libera energía en forma de calor y luz, lo que es fundamental en procesos como la combustión.
Un ejemplo clásico de esta reactividad es la oxidación. Cuando el hierro se expone al oxígeno y la humedad, se forma óxido de hierro, o lo que comúnmente llamamos «herrumbre». Este es solo un pequeño vistazo a cómo el oxígeno se comporta químicamente, pero su importancia va más allá de reacciones simples. En la biología, por ejemplo, el oxígeno es esencial para la respiración celular, un proceso que libera energía de los alimentos.
Aplicaciones del Oxígeno
En la Medicina
Una de las aplicaciones más críticas del oxígeno es en el campo de la medicina. La terapia de oxígeno se utiliza para tratar una variedad de condiciones, desde problemas respiratorios hasta enfermedades cardíacas. Al aumentar la cantidad de oxígeno disponible para el cuerpo, se puede mejorar la función celular y ayudar en la recuperación de los pacientes.
Además, en situaciones de emergencia, como en el caso de accidentes o enfermedades agudas, el oxígeno puede ser un salvavidas literal. Por ejemplo, los bomberos y los equipos de rescate a menudo llevan tanques de oxígeno para ayudar a las personas atrapadas en situaciones donde el aire es escaso.
En la Industria
El oxígeno también tiene un papel crucial en la industria. Se utiliza en procesos de soldadura, donde se combina con otros gases para crear llamas extremadamente calientes que pueden fundir metales. Además, se utiliza en la producción de acero y otros metales.
La industria química también se beneficia del oxígeno. Se emplea en la producción de productos químicos esenciales, como ácidos y peróxidos. Así que, aunque no lo veamos, el oxígeno está presente en muchas de las cosas que usamos en nuestra vida diaria.
Conclusiones
El modelo de Bohr nos proporciona una ventana fascinante al mundo del oxígeno, revelando no solo su estructura atómica, sino también sus características y aplicaciones. Desde su configuración electrónica hasta su reactividad química, el oxígeno es un elemento que juega un papel vital en la naturaleza y en nuestras vidas.
Al final del día, el oxígeno no es solo un gas que respiramos; es un elemento dinámico que impulsa innumerables procesos biológicos e industriales. Así que la próxima vez que tomes un respiro profundo, recuerda que estás interactuando con uno de los elementos más importantes de nuestro universo.
Preguntas Frecuentes
¿Por qué el oxígeno es tan reactivo?
El oxígeno es reactivo porque busca completar su nivel de energía exterior, que tiene seis electrones. Esta búsqueda de estabilidad lo lleva a formar enlaces con otros elementos.
¿Qué papel juega el oxígeno en la respiración celular?
En la respiración celular, el oxígeno se utiliza para descomponer la glucosa, liberando energía que las células utilizan para funcionar.
¿Puede el oxígeno existir en otras formas además de gas?
Sí, el oxígeno puede existir como líquido a temperaturas muy bajas y también en forma de ozono (O₃), que es una forma de oxígeno en la atmósfera.
¿Qué aplicaciones industriales tiene el oxígeno?
El oxígeno se utiliza en la soldadura, la producción de acero, y en la fabricación de productos químicos, entre otros.
¿Cómo se mide la cantidad de oxígeno en el aire?
La cantidad de oxígeno en el aire se mide utilizando un medidor de oxígeno, que puede proporcionar lecturas precisas de la concentración de oxígeno en el ambiente.