Todo lo que Necesitas Saber sobre la Ley de las Proporciones Definidas de Proust
Una Introducción a la Ley de Proust
¡Hola, amigo lector! Hoy vamos a adentrarnos en un concepto fascinante de la química que, aunque puede sonar un poco técnico, es realmente interesante y fácil de entender: la Ley de las Proporciones Definidas de Proust. Este principio, que fue formulado por el químico francés Joseph Proust a principios del siglo XIX, establece que un compuesto químico siempre se forma a partir de los mismos elementos en proporciones fijas. Pero, ¿qué significa esto realmente? Vamos a desglosarlo juntos, paso a paso.
¿Qué es la Ley de las Proporciones Definidas?
Para empezar, imagina que estás horneando un pastel. Si decides hacer un pastel de chocolate, necesitarás una receta que incluya ciertos ingredientes: harina, azúcar, huevos, chocolate y mantequilla. Ahora, si sigues la receta al pie de la letra, digamos que usas 200 gramos de harina, 100 gramos de azúcar y 50 gramos de chocolate, el resultado siempre será un pastel de chocolate delicioso. Sin embargo, si decides agregar más chocolate o menos azúcar, el resultado puede no ser el mismo. En el mundo de la química, esto se traduce en que los compuestos se forman a partir de elementos en proporciones específicas, y si cambias esas proporciones, cambias el compuesto.
La Historia Detrás de la Ley
La Ley de las Proporciones Definidas fue una de las contribuciones más significativas de Proust a la química. Antes de él, muchos científicos, como Antoine Lavoisier, ya habían comenzado a estudiar la composición de los compuestos, pero fue Proust quien realmente destacó la importancia de las proporciones. En su famoso experimento, analizó varios compuestos, incluyendo el carbonato de cobre, y descubrió que independientemente de cómo se preparara, siempre contenía la misma proporción de cobre, carbono y oxígeno. Esto fue un gran avance, ya que sentó las bases para el desarrollo de la química moderna y la teoría atómica.
¿Por Qué es Importante Esta Ley?
Entonces, ¿por qué deberías preocuparte por la Ley de Proust? Bueno, esta ley es fundamental para entender cómo se forman los compuestos químicos y cómo interactúan entre sí. Sin esta ley, no podríamos predecir cómo reaccionarán diferentes elementos cuando se combinan. Piensa en ello como si fueras un chef: si no conoces las proporciones correctas de los ingredientes, no puedes esperar que tu plato tenga buen sabor. Del mismo modo, en la química, si no comprendes las proporciones, no puedes predecir los resultados de las reacciones químicas.
Ejemplos Prácticos de la Ley
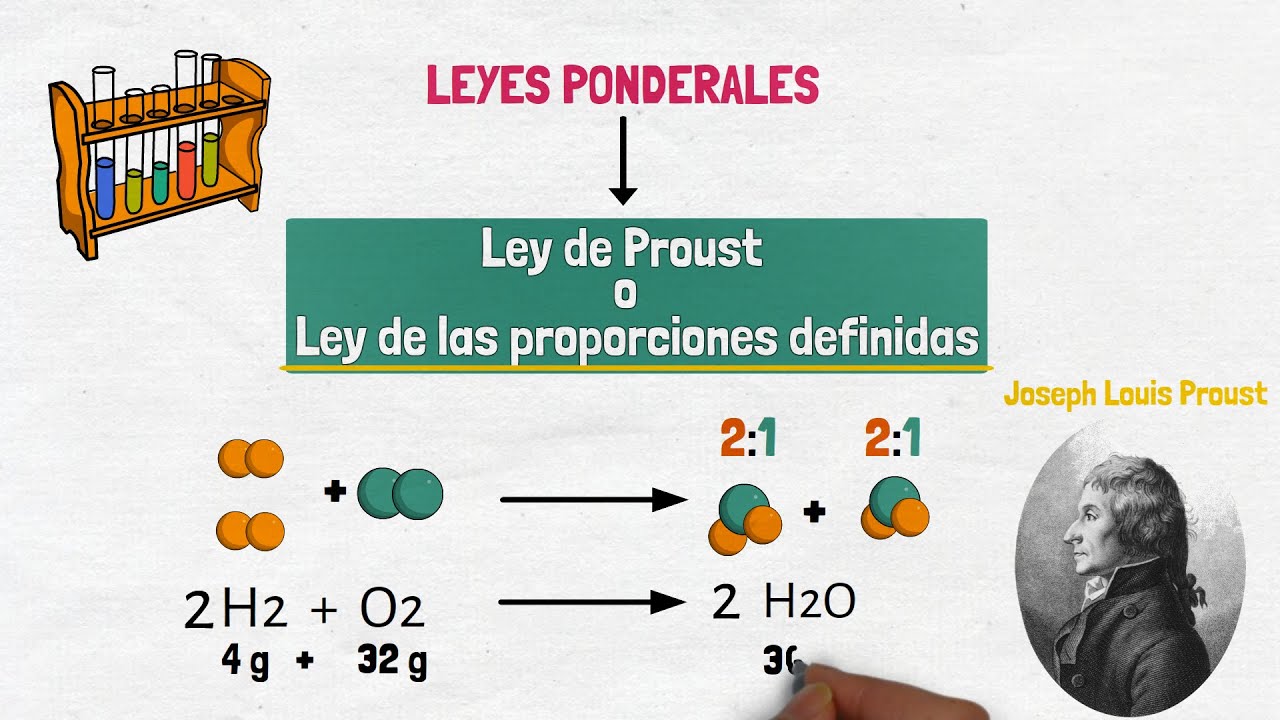
Veamos algunos ejemplos prácticos. Tomemos el agua, por ejemplo. Sabemos que está compuesta por dos átomos de hidrógeno y uno de oxígeno, lo que se traduce en una proporción de 2:1. Esto significa que, sin importar cómo obtengas el agua, siempre tendrá esta misma proporción. Si intentas hacer agua con una proporción diferente, como 3 átomos de hidrógeno por 1 de oxígeno, obtendrás algo completamente diferente, no agua. Este es el poder de la Ley de Proust.
Relación con la Teoría Atómica
La Ley de las Proporciones Definidas está estrechamente relacionada con la teoría atómica. La teoría atómica, desarrollada más tarde por científicos como John Dalton, establece que cada elemento está compuesto por átomos de un tipo particular y que los compuestos se forman a partir de la unión de estos átomos en proporciones definidas. Así que, en cierto sentido, la Ley de Proust es un ladrillo fundamental en la construcción del edificio de la química moderna.
Relevancia en la Química Moderna
Hoy en día, la Ley de las Proporciones Definidas sigue siendo relevante en la química moderna. Los químicos utilizan este principio para crear nuevos compuestos y entender cómo se comportan en diferentes condiciones. Desde la creación de nuevos medicamentos hasta la fabricación de materiales avanzados, esta ley sigue siendo una guía esencial. Así que, la próxima vez que escuches sobre un nuevo avance en la química, recuerda que la Ley de Proust está en el corazón de ese descubrimiento.
Más Allá de Proust: Otras Leyes Importantes
Ahora que hemos cubierto la Ley de Proust, es interesante ver cómo se relaciona con otras leyes de la química. Por ejemplo, la Ley de las Proporciones Múltiples, que establece que cuando dos elementos se combinan para formar más de un compuesto, las masas de uno de los elementos que se combinan con una masa fija del otro están en una relación de números enteros simples. Es un poco como hacer diferentes tipos de salsas con los mismos ingredientes, pero en diferentes cantidades. ¡La química es realmente asombrosa!
La Ley de Conservación de la Masa
Otra ley que es fundamental en química es la Ley de Conservación de la Masa, que nos dice que la masa total de los reactivos en una reacción química siempre es igual a la masa total de los productos. Así que, si bien la Ley de Proust se centra en las proporciones de los elementos en un compuesto, la Ley de Conservación de la Masa se asegura de que no se «pierda» nada en el proceso. Es como asegurarte de que no dejas caer ningún ingrediente mientras cocinas, ¡porque no querrás que tu pastel se arruine!
Preguntas Frecuentes
¿La Ley de Proust se aplica a todos los compuestos?
Sí, la Ley de las Proporciones Definidas se aplica a todos los compuestos químicos, ya sean simples como el agua o más complejos como las proteínas. Siempre que un compuesto esté formado por elementos en proporciones fijas, la ley es válida.
¿Qué sucede si cambio las proporciones de los elementos en un compuesto?
Si cambias las proporciones de los elementos en un compuesto, obtendrás un compuesto diferente. Por ejemplo, si intentas combinar hidrógeno y oxígeno en una proporción diferente a 2:1, no obtendrás agua, sino algo completamente distinto.
¿La Ley de Proust es relevante hoy en día?
Absolutamente. La Ley de Proust sigue siendo fundamental en la química moderna y se utiliza en la investigación y el desarrollo de nuevos compuestos y materiales.
¿Cómo se relaciona la Ley de Proust con la química orgánica?
La Ley de Proust es esencial para la química orgánica, que se centra en el estudio de compuestos que contienen carbono. La comprensión de las proporciones de los elementos en los compuestos orgánicos es crucial para la síntesis y el análisis de nuevos fármacos y materiales.
¿Puedo ver la Ley de Proust en acción en la vida cotidiana?
¡Definitivamente! Cada vez que cocinas, estás utilizando principios similares a la Ley de Proust. La forma en que mides los ingredientes y sigues las recetas es un reflejo de la importancia de las proporciones en la química.
En resumen, la Ley de las Proporciones Definidas de Proust es un principio fundamental que nos ayuda a entender el mundo de los compuestos químicos y su formación. Al igual que seguir una receta, las proporciones son clave para obtener los resultados deseados. Así que la próxima vez que cocines o pienses en una reacción química, recuerda la sabiduría de Proust y cómo su descubrimiento ha moldeado nuestra comprensión de la química moderna.