Cómo se Manifiesta la Energía en una Reacción Química: Explicación y Ejemplos
Entendiendo el Rol de la Energía en las Reacciones Químicas
Cuando pensamos en una reacción química, a menudo nos imaginamos algo así como una película de acción: hay explosiones, transformaciones, y en ocasiones, resultados sorprendentes. Pero, ¿alguna vez te has preguntado qué hay detrás de todo esto? ¿Qué es lo que realmente ocurre a nivel molecular? La energía es el hilo conductor de estas reacciones, y entender cómo se manifiesta puede desvelar muchos secretos de la química. A lo largo de este artículo, vamos a explorar cómo la energía se transforma y se mueve durante una reacción química, utilizando ejemplos que hacen que todo sea más claro y, por supuesto, ¡más divertido!
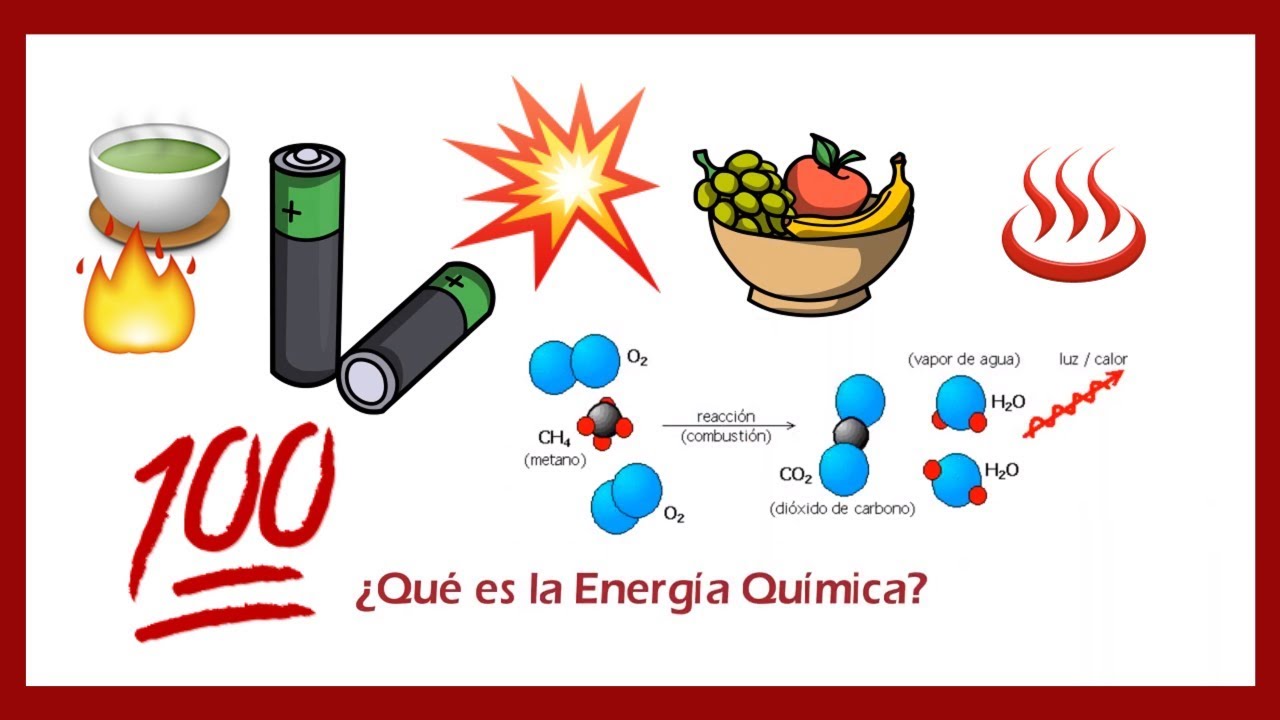
¿Qué es la Energía Química?
La energía química es la energía almacenada en los enlaces de los átomos y las moléculas. Imagina que cada enlace es como una cuerda elástica: cuanto más estirada está, más energía tiene. Cuando ocurre una reacción química, estas cuerdas se rompen y se vuelven a formar, liberando o absorbiendo energía en el proceso. Así que, cuando mezclas ingredientes en la cocina, en realidad estás orquestando una danza de energía. ¿No es fascinante pensar en lo que ocurre en el fondo de tu olla?
Tipos de Energía en Reacciones Químicas
Existen principalmente dos tipos de energía que juegan un papel crucial en las reacciones químicas: la energía cinética y la energía potencial. La energía cinética es la energía del movimiento, mientras que la energía potencial es la energía almacenada. En una reacción química, cuando los reactivos se encuentran, la energía cinética de sus moléculas puede ser suficiente para romper los enlaces existentes, lo que permite que se formen nuevos enlaces. ¿Te imaginas a las moléculas como pequeños bailarines, moviéndose con energía hasta que encuentran a su pareja perfecta?
Reacciones Exotérmicas y Endotérmicas
Ahora que hemos hablado de la energía química, es hora de introducir dos términos que seguramente escucharás con frecuencia: reacciones exotérmicas y endotérmicas. Estas dos categorías son como dos caras de una moneda, y entenderlas es clave para comprender cómo se manifiesta la energía en las reacciones químicas.
Reacciones Exotérmicas
Las reacciones exotérmicas son aquellas que liberan energía al entorno, generalmente en forma de calor. Un ejemplo clásico es la combustión. Cuando enciendes una fogata, estás llevando a cabo una reacción exotérmica: el fuego libera calor y luz. Es como si las moléculas de combustible estuvieran celebrando una fiesta y decidieran compartir su energía con todos. Esto no solo calienta el ambiente, sino que también puede ser utilizado para cocinar o calentar agua. ¿Te imaginas cómo las antiguas civilizaciones dependían de este tipo de reacciones para sobrevivir?
Reacciones Endotérmicas
Por otro lado, tenemos las reacciones endotérmicas, que son aquellas que absorben energía del entorno. Un ejemplo de esto es la fotosíntesis, donde las plantas absorben luz solar para convertir dióxido de carbono y agua en glucosa y oxígeno. Aquí, la energía de la luz se convierte en energía química, almacenada en los enlaces de la glucosa. ¡Es como si las plantas estuvieran cocinando su propia comida a partir de la luz del sol! ¿No es asombroso cómo algo tan simple como una hoja puede llevar a cabo un proceso tan complejo?
La Energía de Activación
Ahora que hemos explorado cómo la energía se manifiesta en diferentes tipos de reacciones, hablemos de un concepto crucial: la energía de activación. Imagina que estás tratando de empujar una piedra grande cuesta arriba. Necesitas un impulso inicial para superar la resistencia. En el mundo de las reacciones químicas, la energía de activación es el «empuje» que se necesita para iniciar una reacción. Sin ella, incluso las reacciones más favorables no ocurrirán.
¿Cómo se Puede Modificar la Energía de Activación?
Aquí es donde entran en juego los catalizadores. Los catalizadores son sustancias que pueden disminuir la energía de activación, facilitando que la reacción ocurra más rápidamente. Imagina que el catalizador es como un amigo que te ayuda a empujar esa piedra: hace que el trabajo sea mucho más fácil. Un ejemplo cotidiano de esto es la enzima en tu saliva que ayuda a descomponer los alimentos. Sin ella, la digestión sería un proceso mucho más lento y complicado. Así que, ¡viva la química!
Ejemplos Cotidianos de Energía en Reacciones Químicas
Para que todo esto sea aún más claro, exploremos algunos ejemplos cotidianos que ilustran cómo se manifiesta la energía en las reacciones químicas.
La Reacción del Vinagre y el Bicarbonato
Un experimento clásico en la cocina es mezclar vinagre con bicarbonato de sodio. Esta reacción produce dióxido de carbono, que se manifiesta en forma de burbujas. Aquí, la energía se libera en forma de gas, y puedes observar cómo se produce efervescencia. Es como si estuvieras viendo una pequeña erupción volcánica en tu cocina. ¡Y todo esto sucede gracias a la energía que se libera en la reacción química!
El Proceso de Cocción
Cuando cocinas, estás involucrado en una serie de reacciones químicas. Por ejemplo, al hornear un pastel, la mezcla de ingredientes se calienta, provocando reacciones que transforman la harina, el azúcar y otros componentes en una deliciosa golosina. Durante este proceso, se libera energía en forma de calor, y puedes oler los aromas que surgen. ¿Alguna vez has pensado en cuánta química hay en ese simple acto de hornear?
La Energía en la Vida Diaria
La energía en las reacciones químicas no solo se limita a la cocina; está presente en casi todos los aspectos de nuestra vida diaria. Desde la respiración hasta la digestión, cada vez que nuestro cuerpo realiza una función, está utilizando energía química.
Respiración Celular
Cuando respiramos, nuestros cuerpos realizan una reacción química que convierte el oxígeno y la glucosa en energía. Este proceso, conocido como respiración celular, libera energía que nuestras células utilizan para funcionar. Así que, cada vez que tomas aire, estás participando en una reacción química que te mantiene vivo. ¿Te has detenido a pensar en la maravilla que es este proceso biológico?
Las Baterías
Las baterías son otro ejemplo fascinante de cómo se manifiesta la energía en reacciones químicas. Cuando una batería se descarga, se producen reacciones químicas que liberan energía eléctrica. Esta energía es la que alimenta tus dispositivos electrónicos, desde tu teléfono hasta tu computadora. Es como tener una pequeña planta de energía en tu bolsillo. ¡Increíble, verdad?
Preguntas Frecuentes
¿Qué sucede con la energía en una reacción química?
En una reacción química, la energía puede ser liberada o absorbida, dependiendo del tipo de reacción. En reacciones exotérmicas, se libera energía, mientras que en reacciones endotérmicas, se absorbe energía del entorno.
¿Cómo se puede medir la energía en una reacción química?
La energía en una reacción química se puede medir utilizando calorímetros, que permiten determinar la cantidad de calor liberado o absorbido durante la reacción.
¿Qué papel juegan los catalizadores en las reacciones químicas?
Los catalizadores son sustancias que aceleran las reacciones químicas al disminuir la energía de activación, facilitando así que la reacción ocurra más rápidamente.
¿Por qué es importante entender la energía en las reacciones químicas?
Comprender la energía en las reacciones químicas es fundamental para muchas áreas, desde la química y la biología hasta la ingeniería y la medicina. Nos ayuda a desarrollar nuevos procesos, medicamentos y tecnologías más eficientes.
¿Cómo afecta la temperatura a las reacciones químicas?
La temperatura puede influir significativamente en las reacciones químicas. En general, un aumento de temperatura incrementa la energía cinética de las moléculas, lo que puede acelerar la reacción al aumentar la frecuencia de colisiones efectivas entre las moléculas.
Este artículo aborda de manera clara y detallada cómo se manifiesta la energía en las reacciones químicas, utilizando un estilo conversacional y ejemplos cotidianos para involucrar al lector.