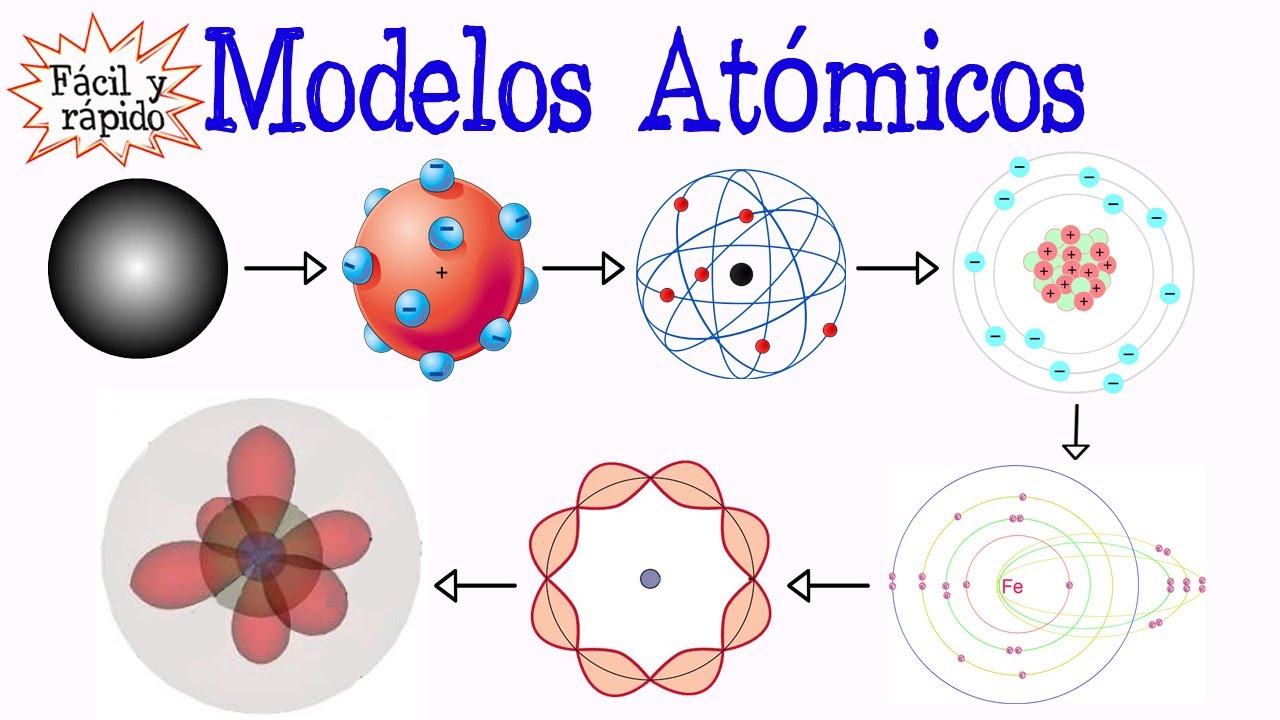
¿Qué es un modelo atómico? Explicación y Tipos de Modelos Atómicos
Cuando hablamos de la estructura de la materia, uno de los conceptos más fascinantes es el modelo atómico. Pero, ¿qué significa realmente? Un modelo atómico es, en esencia, una representación conceptual que nos ayuda a entender cómo están organizados los átomos y cómo se comportan. Estos modelos han evolucionado a lo largo del tiempo, desde la antigua idea de Demócrito de que la materia estaba compuesta por partículas indivisibles, hasta los complejos modelos cuánticos que utilizamos hoy en día. Cada uno de estos modelos ha aportado algo valioso a nuestra comprensión de la química y la física, y cada uno refleja los conocimientos y tecnologías disponibles en su época.
Tipos de Modelos Atómicos a lo Largo de la Historia
La historia de los modelos atómicos es un viaje fascinante que nos lleva desde la antigüedad hasta la era moderna. Imagina por un momento que estás en una sala de clases en la antigua Grecia, escuchando a Demócrito hablar sobre su idea de que todo está hecho de «átomos», que son indivisibles y eternos. Esta idea, aunque rudimentaria, sentó las bases para el desarrollo posterior de la química. Pero, ¿cómo hemos llegado a los modelos que conocemos hoy? Acompáñame en este recorrido.
Modelo de Dalton: La Materia como Bolitas
En el siglo XIX, el químico John Dalton propuso un modelo que podría considerarse un avance significativo. Imagina que los átomos son como bolitas de un juego de canicas. Según Dalton, cada tipo de átomo tenía un peso y un tamaño específicos. Este modelo se basa en la idea de que los átomos se combinan en proporciones fijas para formar compuestos. Aunque este modelo tenía sus limitaciones, fue fundamental para el desarrollo de la teoría atómica moderna. ¿No es curioso cómo una idea tan simple puede haber cambiado la forma en que vemos la materia?
Limitaciones del Modelo de Dalton
A pesar de su éxito inicial, el modelo de Dalton no pudo explicar ciertos fenómenos, como la existencia de isótopos, átomos del mismo elemento con diferentes masas. A medida que la ciencia avanzaba, también lo hacía nuestra comprensión de la estructura atómica. Así que, ¿qué vino después?
Modelo de Thomson: El Pudín de Ciruelas
En 1897, J.J. Thomson descubrió el electrón, lo que llevó a una nueva comprensión del átomo. Su modelo, conocido como el «modelo del pudín de ciruelas», imaginaba el átomo como una esfera cargada positivamente con electrones incrustados en ella, como las ciruelas en un pudín. Este modelo fue revolucionario porque introdujo la idea de que los átomos no eran indivisibles, sino que contenían partículas subatómicas. Pero, ¿era este modelo suficiente para explicar todas las propiedades de los átomos?
Críticas al Modelo de Thomson
Aunque el modelo de Thomson fue un gran avance, no pudo explicar la estabilidad de los átomos ni la forma en que los electrones se organizan en torno al núcleo. Así que, la búsqueda de un modelo más preciso continuó. ¿Te imaginas lo emocionante que debió ser para los científicos de la época ver cómo sus ideas evolucionaban y se desafiaban constantemente?
Modelo de Rutherford: El Núcleo Atómico
En 1911, Ernest Rutherford realizó su famoso experimento de dispersión de partículas alfa, que reveló que el átomo tiene un núcleo denso y positivo en su centro, rodeado de electrones que orbitan a su alrededor. Este modelo, a menudo descrito como un sistema solar a escala atómica, cambió drásticamente nuestra comprensión de la estructura atómica. ¿Quién podría haber imaginado que el átomo era en gran parte vacío?
El Problema de la Estabilidad
Sin embargo, el modelo de Rutherford también tenía sus problemas. Los electrones, al moverse en órbitas, deberían emitir energía y eventualmente caer en el núcleo, lo que significaría que los átomos no podrían ser estables. ¿Cómo podrían existir los átomos si estaban condenados a desintegrarse? La respuesta llegó con la siguiente gran revolución en la teoría atómica.
Modelo Cuántico: La Dualidad de Partícula y Onda
La llegada de la mecánica cuántica en el siglo XX trajo consigo un nuevo enfoque para entender el átomo. El modelo cuántico, propuesto por científicos como Niels Bohr y más tarde desarrollado por Erwin Schrödinger, introduce la idea de que los electrones no tienen órbitas definidas, sino que existen en «nubes de probabilidad». En lugar de pensar en los electrones como pequeñas bolas que giran alrededor del núcleo, ahora los vemos como ondas que ocupan ciertas áreas alrededor del núcleo. ¡Es como si estuviéramos hablando de bailarines en una pista de baile en lugar de coches en una carretera!
La Importancia de la Mecánica Cuántica
Este modelo cuántico no solo explica la estabilidad de los átomos, sino que también permite entender fenómenos como la espectroscopía, que estudia cómo los átomos absorben y emiten luz. Gracias a la mecánica cuántica, podemos comprender mejor cómo interactúan los átomos entre sí y cómo forman enlaces químicos. ¿Te imaginas el impacto que esto ha tenido en la tecnología moderna, desde la electrónica hasta la medicina?
Modelos Atómicos en la Era Moderna
A medida que la ciencia avanza, también lo hacen nuestros modelos atómicos. Hoy en día, utilizamos modelos más complejos que integran conceptos de la teoría cuántica y la relatividad. Estos modelos son cruciales para campos como la química cuántica, la física de partículas y la nanotecnología. ¿Qué más nos depara el futuro en nuestra búsqueda de entender la materia?
Modelos en la Investigación Actual
En la actualidad, los científicos continúan desarrollando nuevos modelos y teorías para explicar los fenómenos que aún no comprendemos completamente. Desde la búsqueda de partículas subatómicas como los quarks hasta la exploración de la materia oscura y la energía oscura, el viaje del modelo atómico está lejos de haber terminado. ¿No es emocionante pensar en lo que aún nos queda por descubrir?
Conclusión: La Evolución del Conocimiento Atómico
Los modelos atómicos han recorrido un largo camino desde las simples ideas de Demócrito hasta las complejidades de la mecánica cuántica. Cada modelo ha sido un paso importante en nuestra búsqueda por entender la naturaleza de la materia. A medida que la ciencia avanza, también lo hacen nuestras herramientas y métodos, permitiéndonos explorar el universo de maneras que antes eran inimaginables. Así que la próxima vez que pienses en un átomo, recuerda que estás mirando una historia llena de descubrimientos, desafíos y, sobre todo, curiosidad. ¿Qué nuevas preguntas te surgen sobre el mundo atómico?
Preguntas Frecuentes
1. ¿Cuál es la diferencia entre un átomo y una molécula?
Un átomo es la unidad básica de un elemento, mientras que una molécula es un grupo de átomos unidos químicamente. Por ejemplo, el agua (H2O) es una molécula compuesta por dos átomos de hidrógeno y uno de oxígeno.
2. ¿Qué son los isótopos?
Los isótopos son átomos del mismo elemento que tienen el mismo número de protones pero diferentes números de neutrones, lo que resulta en diferentes masas atómicas. Por ejemplo, el carbono-12 y el carbono-14 son isótopos del carbono.
3. ¿Cómo se relacionan los modelos atómicos con la química?
Los modelos atómicos son fundamentales para la química, ya que nos ayudan a entender cómo los átomos se combinan para formar moléculas y compuestos, así como a predecir el comportamiento químico de diferentes sustancias.
4. ¿Por qué es importante la mecánica cuántica en la comprensión de los átomos?
La mecánica cuántica es crucial porque explica el comportamiento de los electrones en los átomos y cómo interactúan entre sí. Sin esta teoría, no podríamos entender fenómenos como la estructura de los átomos y la formación de enlaces químicos.
5. ¿Qué futuro tienen los modelos atómicos?
Los modelos atómicos seguirán evolucionando a medida que avancemos en la ciencia y la tecnología. Con cada nuevo descubrimiento, nuestros modelos se ajustan y mejoran, lo que nos permite comprender mejor el universo y desarrollar nuevas aplicaciones en diversos campos.