Diferencias entre los Modelos Atómicos: Una Guía Completa para Entender la Estructura del Átomo
Introducción a los Modelos Atómicos
¿Alguna vez te has preguntado qué es realmente un átomo y cómo se estructura? Imagina que los átomos son como pequeñas ciudades en un vasto universo. Cada ciudad tiene su propia organización, sus propias reglas y su propio estilo de vida. Desde la antigüedad, los científicos han intentado desentrañar los misterios de estos diminutos componentes de la materia, y a lo largo del tiempo, han desarrollado diferentes modelos atómicos para explicar cómo funcionan. En este artículo, exploraremos las diferencias entre estos modelos, desde el clásico modelo de Dalton hasta el más complejo modelo cuántico, para que puedas entender mejor cómo se forma la materia que nos rodea.
A lo largo de la historia, cada modelo atómico ha sido como una pieza de un rompecabezas que, al juntarse, nos da una imagen más clara de la estructura atómica. Así que, si estás listo para sumergirte en este viaje fascinante, acompáñame y descubramos juntos las particularidades de cada modelo atómico y cómo han evolucionado a lo largo del tiempo. ¡Vamos a ello!
El Modelo de Dalton: La Base de Todo
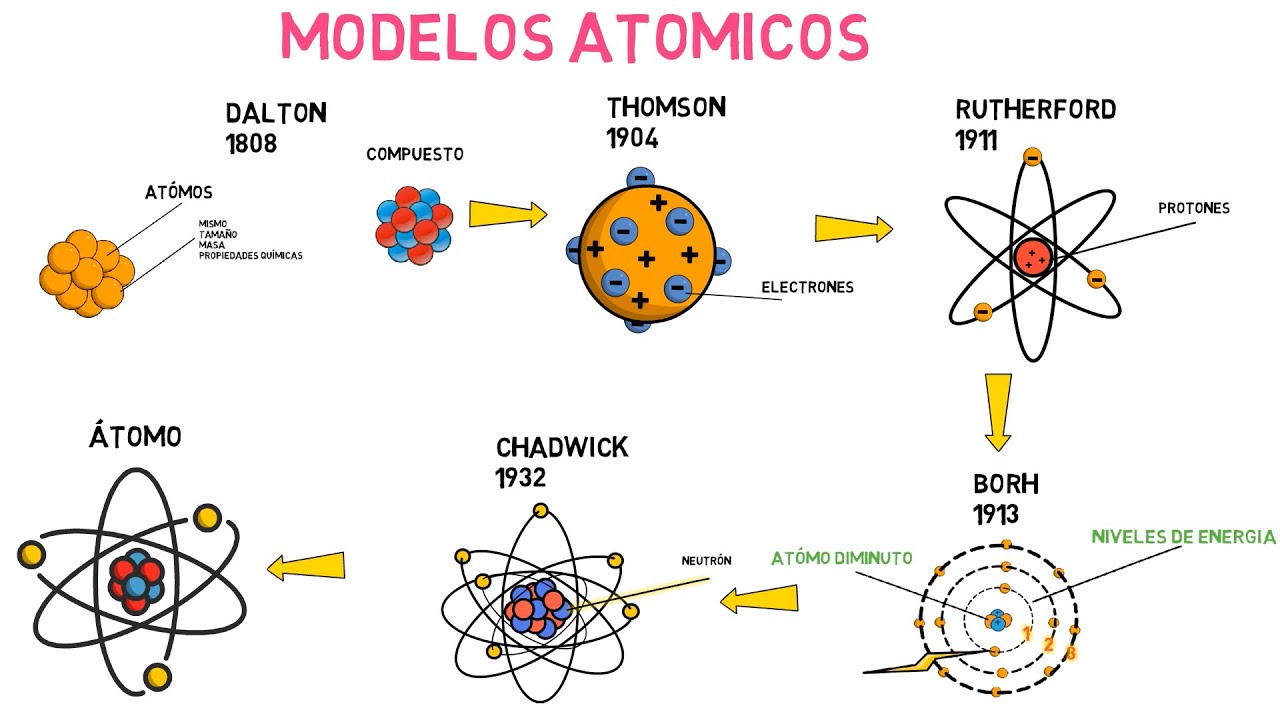
El primer modelo atómico que debemos mencionar es el de John Dalton, propuesto a principios del siglo XIX. Dalton imaginó los átomos como esferas sólidas e indivisibles, similares a canicas. Según él, cada elemento estaba compuesto por átomos de un tipo específico, y estos átomos podían combinarse en proporciones fijas para formar compuestos. Este modelo fue revolucionario en su época, ya que sentó las bases de la teoría atómica moderna.
Sin embargo, este modelo tenía sus limitaciones. Dalton no pudo explicar fenómenos como la conductividad eléctrica o la emisión de luz por parte de ciertos elementos. A medida que avanzaba la investigación, otros científicos comenzaron a desafiar y expandir las ideas de Dalton.
Características del Modelo de Dalton
1. Indivisibilidad: Dalton creía que los átomos eran partículas indivisibles, lo que significa que no podían ser divididos en partes más pequeñas.
2. Especificidad: Cada elemento tiene átomos únicos que se diferencian de los átomos de otros elementos.
3. Conservación de la masa: Durante las reacciones químicas, los átomos no se crean ni se destruyen, solo se reorganizan.
El Modelo de Thomson: El Pudín de Ciruelas
Luego llegó J.J. Thomson a finales del siglo XIX, quien descubrió el electrón. Su modelo, conocido como el «modelo del pudín de ciruelas», representaba al átomo como una esfera cargada positivamente, en la que los electrones (las ciruelas) estaban incrustados. Este modelo fue un gran avance, ya que introdujo la idea de que los átomos podían ser divididos en partículas más pequeñas.
Sin embargo, a pesar de ser innovador, el modelo de Thomson no podía explicar cómo los electrones se mantenían en su lugar ni cómo se formaban los espectros atómicos. La búsqueda de respuestas continuaba.
Características del Modelo de Thomson
1. Carga positiva y negativa: El átomo tiene una carga positiva general con electrones distribuidos en su interior.
2. Divisibilidad: Los átomos pueden ser divididos en partículas subatómicas, como electrones y protones.
3. Estructura homogénea: Los electrones están uniformemente distribuidos a lo largo del átomo.
El Modelo de Rutherford: El Núcleo Atómico
A principios del siglo XX, Ernest Rutherford realizó su famoso experimento de la lámina de oro. A partir de sus observaciones, propuso un nuevo modelo atómico que describía al átomo como un sistema planetario. En este modelo, el núcleo (donde se concentran los protones y neutrones) es extremadamente pequeño en comparación con el tamaño del átomo, y los electrones orbitan alrededor de este núcleo, como planetas alrededor del sol.
Rutherford demostró que la mayor parte del volumen del átomo era espacio vacío, lo que contradice la idea de un átomo sólido. Sin embargo, su modelo también tenía limitaciones, ya que no explicaba la estabilidad de los electrones en sus órbitas.
Características del Modelo de Rutherford
1. Núcleo denso: La mayor parte de la masa del átomo se concentra en un pequeño núcleo central.
2. Espacio vacío: La mayor parte del átomo es espacio vacío, donde los electrones se mueven.
3. Órbitas de electrones: Los electrones orbitan el núcleo, pero su comportamiento no está bien definido.
El Modelo de Bohr: La Cuantización de las Órbitas
Niels Bohr tomó las ideas de Rutherford y las amplió en 1913. Propuso que los electrones se movían en órbitas fijas alrededor del núcleo y que estas órbitas tenían niveles de energía específicos. Esto significaba que los electrones podían saltar entre órbitas, absorbiendo o emitiendo energía en forma de luz. Este modelo fue un gran avance, ya que pudo explicar la estabilidad de los átomos y los espectros de emisión de los elementos.
Sin embargo, aunque el modelo de Bohr funcionaba bien para el hidrógeno, no podía aplicarse a átomos más complejos. Así que, como es habitual en la ciencia, la búsqueda de un modelo más completo continuaba.
Características del Modelo de Bohr
1. Órbitas cuantizadas: Los electrones solo pueden ocupar ciertas órbitas con niveles de energía específicos.
2. Emisión de energía: Cuando un electrón salta entre órbitas, emite o absorbe energía en forma de fotones.
3. Estabilidad: El modelo explica la estabilidad de los átomos, al igual que la formación de espectros atómicos.
El Modelo Cuántico: La Complejidad del Mundo Subatómico
Finalmente, llegamos al modelo cuántico, que es el que más se utiliza hoy en día. Este modelo, basado en la mecánica cuántica, considera que los electrones no tienen órbitas fijas, sino que existen en «nubes de probabilidad». En lugar de tener trayectorias definidas, los electrones se describen en términos de probabilidades, lo que significa que no podemos saber exactamente dónde se encuentran en un momento dado.
Este modelo ha revolucionado nuestra comprensión del átomo y ha llevado a avances en la tecnología, como los semiconductores y la computación cuántica. Pero, como todo en la ciencia, también tiene sus limitaciones y sigue siendo objeto de investigación.
Características del Modelo Cuántico
1. Nubes de probabilidad: Los electrones existen en regiones donde es probable encontrarlos, en lugar de seguir trayectorias fijas.
2. Principio de incertidumbre: Es imposible conocer simultáneamente la posición y la velocidad de un electrón con precisión.
3. Interacción de partículas: Los electrones pueden interactuar de maneras complejas que no se pueden predecir fácilmente.
Comparación de los Modelos Atómicos
Es fascinante observar cómo cada modelo atómico ha aportado algo valioso a nuestra comprensión de la materia. Desde el modelo de Dalton, que nos enseñó que la materia está compuesta por átomos, hasta el modelo cuántico, que nos muestra la complejidad del comportamiento subatómico, cada uno ha sido un peldaño en la escalera del conocimiento científico.
| Modelo | Principal Contribución | Limitaciones |
|—————|————————————————-|————————————————|
| Dalton | Teoría atómica básica | No explica la divisibilidad del átomo |
| Thomson | Descubrimiento del electrón | No explica la estabilidad de los átomos |
| Rutherford | Núcleo atómico y espacio vacío | No define el comportamiento de los electrones |
| Bohr | Órbitas cuantizadas y emisión de energía | Solo aplicable a átomos simples como el hidrógeno |
| Cuántico | Nubes de probabilidad y mecánica cuántica | Complejidad en la predicción de comportamientos |
Conclusión: La Evolución del Conocimiento Atómico
En resumen, los modelos atómicos han evolucionado a lo largo del tiempo, cada uno aportando nuevas ideas y conceptos que han ayudado a construir nuestra comprensión actual de la materia. Desde los sólidos e indivisibles átomos de Dalton hasta las complejas nubes de probabilidad del modelo cuántico, cada paso ha sido crucial para desentrañar los misterios del universo a nivel atómico.
Si te has sentido fascinado por este recorrido, ¡no estás solo! La ciencia es un campo en constante evolución, y siempre hay más por descubrir. Así que, la próxima vez que mires a tu alrededor, recuerda que todo lo que ves está compuesto por átomos, esos pequeños pero poderosos bloques de construcción de la vida.
Preguntas Frecuentes
¿Por qué los modelos atómicos han cambiado con el tiempo?
Los modelos atómicos han cambiado a medida que se han realizado nuevos descubrimientos y experimentos. Cada modelo ha tratado de explicar mejor los fenómenos observados, y a medida que la tecnología ha avanzado, también lo ha hecho nuestra comprensión del átomo.
¿Cuál es el modelo atómico más aceptado hoy en día?
El modelo cuántico es el más aceptado hoy en día. Este modelo considera la naturaleza probabilística de los electrones y ha sido fundamental para el desarrollo de la química moderna y la física.
¿Por qué es importante entender los modelos atómicos?
Entender los modelos atómicos es esencial para comprender la materia, las reacciones químicas y la estructura de los elementos. Nos ayuda a explicar fenómenos en la vida diaria y en la tecnología que utilizamos.
¿Cómo se relacionan los modelos atómicos con la química y la física?
Los modelos atómicos son la base de la química y la física, ya que explican cómo interactúan los átomos y cómo se forman las moléculas. Sin una comprensión sólida de estos modelos, sería difícil entender conceptos más complejos en estas disciplinas.
¿Qué impacto tienen los modelos atómicos en la tecnología moderna?
Los modelos atómicos han permitido avances en diversas tecnologías, desde la creación de semiconductores hasta la computación cuántica. Comprender cómo funcionan los átomos y sus interacciones ha sido clave para el desarrollo de muchas innovaciones tecnológicas.