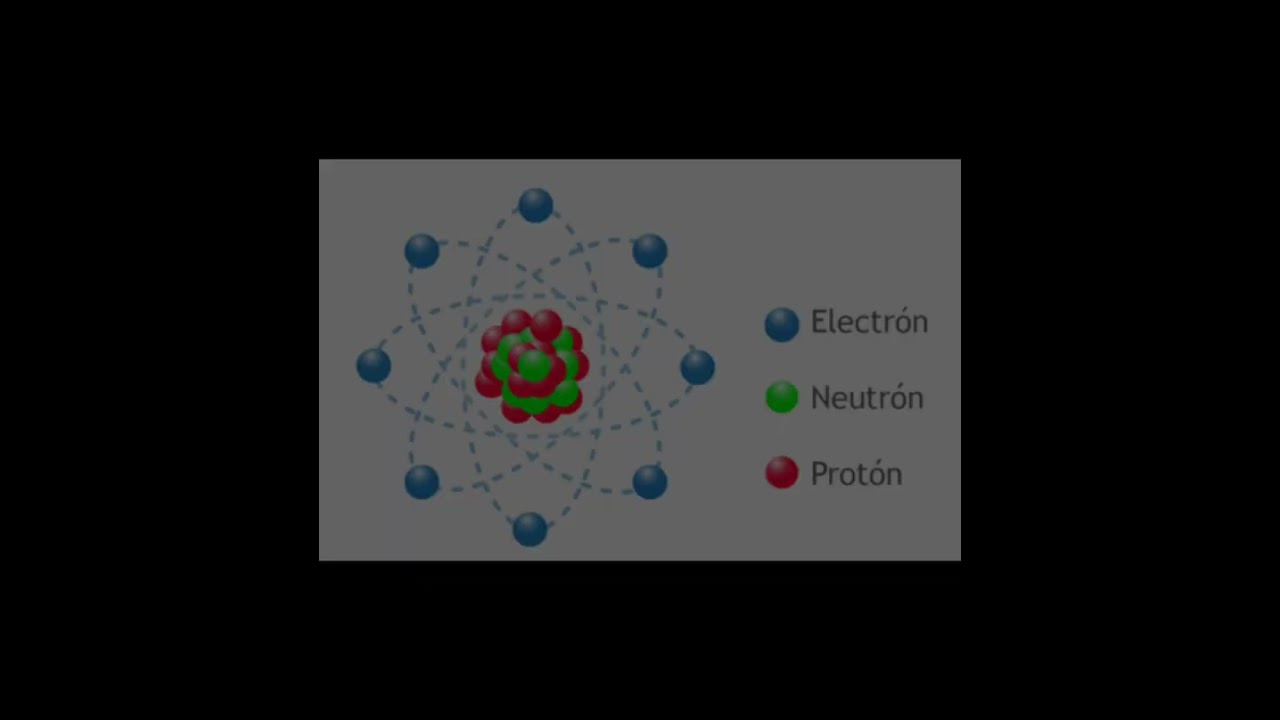
Modelo Atómico de Bohr del Calcio: Explicación y Características Clave
Introducción al Modelo Atómico de Bohr
¿Alguna vez te has preguntado cómo está compuesto el calcio, ese mineral tan importante para nuestros huesos y dientes? El modelo atómico de Bohr es una de las teorías más fascinantes que nos ayuda a entender cómo se organiza un átomo, en este caso, el calcio. Este modelo fue propuesto por el físico danés Niels Bohr en 1913 y revolucionó nuestra comprensión de la estructura atómica. En este artículo, exploraremos en detalle cómo funciona el modelo de Bohr, sus características y cómo se aplica específicamente al calcio.
### ¿Qué es el Modelo Atómico de Bohr?
El modelo atómico de Bohr fue una respuesta a las limitaciones de los modelos anteriores. Antes de Bohr, los científicos luchaban por explicar la estabilidad de los átomos y la emisión de luz en espectros atómicos. Bohr introdujo la idea de que los electrones se mueven en órbitas fijas alrededor del núcleo, similar a cómo los planetas giran alrededor del sol. Pero aquí viene la parte interesante: ¡no cualquier órbita es válida! Solo ciertas órbitas, que corresponden a niveles de energía específicos, son permitidas. Esto significa que los electrones pueden «saltar» de una órbita a otra, pero no pueden existir entre estas órbitas.
### La Estructura del Átomo de Calcio
El calcio, representado por el símbolo Ca en la tabla periódica, es el elemento número 20. Esto significa que tiene 20 protones en su núcleo y, en un átomo neutro, también 20 electrones. En el modelo de Bohr, estos electrones se distribuyen en diferentes niveles de energía. Para el calcio, la configuración electrónica es 2, 8, 8, 2. Esto indica que:
– En la primera capa, hay 2 electrones.
– En la segunda capa, hay 8 electrones.
– En la tercera capa, también hay 8 electrones.
– En la cuarta capa, hay 2 electrones.
Esta distribución es crucial porque determina cómo el calcio interactúa con otros elementos y compuestos. Por ejemplo, el hecho de que el calcio tenga dos electrones en su capa más externa lo hace altamente reactivo, especialmente con elementos como el oxígeno y el cloro.
### Niveles de Energía y Espectros Atómicos
Los niveles de energía son fundamentales para entender cómo los electrones se comportan en un átomo. Imagina que cada nivel de energía es como un peldaño de una escalera. Los electrones pueden estar en el primer peldaño, el segundo o el tercero, pero no pueden estar en medio. Cuando un electrón absorbe energía, puede «saltar» a un nivel superior. Sin embargo, cuando pierde energía, regresa a un nivel más bajo, liberando esa energía en forma de luz. Este fenómeno es lo que causa que los átomos emitan luz de diferentes colores, creando espectros atómicos únicos.
En el caso del calcio, cuando los electrones realizan estas transiciones entre niveles de energía, producen líneas espectrales que son características de este elemento. Esto es increíblemente útil en la espectroscopía, una técnica utilizada para identificar elementos en estrellas y otros cuerpos celestes.
### Comparación con el Modelo de Rutherford
Antes de que Bohr propusiera su modelo, el modelo de Rutherford había establecido que los electrones orbitan alrededor de un núcleo denso y positivo. Sin embargo, este modelo no podía explicar la estabilidad de los átomos ni por qué los electrones no se caen en el núcleo. Bohr, al introducir la idea de niveles de energía cuantizados, proporcionó una solución a estos problemas. Su modelo no solo explicaba la estabilidad, sino que también permitía predecir las longitudes de onda de la luz emitida por los átomos.
### Limitaciones del Modelo de Bohr
Aunque el modelo de Bohr fue un gran avance en la física atómica, no está exento de limitaciones. Por ejemplo, funciona bien para átomos de hidrógeno y otros átomos con un solo electrón, pero se vuelve complicado para átomos más pesados, como el calcio, que tienen múltiples electrones. En estos casos, las interacciones entre electrones complican la imagen, y el modelo de Bohr no puede describir adecuadamente su comportamiento. Aquí es donde entra en juego la mecánica cuántica, que proporciona un marco más completo para entender la estructura atómica.
### Aplicaciones del Modelo de Bohr en la Química
A pesar de sus limitaciones, el modelo de Bohr sigue siendo una herramienta educativa valiosa. Nos ayuda a entender conceptos fundamentales en química, como la formación de enlaces y la reactividad de los elementos. Por ejemplo, en el caso del calcio, su disposición electrónica explica por qué es un metal alcalinotérreo y cómo interactúa con otros elementos para formar compuestos como el óxido de calcio (CaO) o el cloruro de calcio (CaCl₂).
### El Calcio en la Naturaleza y en la Industria
El calcio no es solo un elemento interesante desde el punto de vista atómico; también tiene un papel crucial en la naturaleza y en diversas aplicaciones industriales. Es esencial para la vida, ya que contribuye a la salud ósea y dental. Además, el calcio se utiliza en la construcción (como en el cemento) y en la industria alimentaria (como conservante y en la fortificación de productos lácteos).
### Conclusión
En resumen, el modelo atómico de Bohr nos ofrece una forma fascinante de comprender cómo están organizados los átomos, específicamente el calcio. A través de su estructura de niveles de energía y la interacción de electrones, podemos explicar no solo la química del calcio, sino también su importancia en la vida diaria. Aunque el modelo de Bohr tiene sus limitaciones, su legado en la física y la química es innegable. Nos invita a seguir explorando y aprendiendo sobre el mundo atómico que nos rodea.
### Preguntas Frecuentes
1. ¿Por qué el modelo de Bohr es importante para entender el calcio?
– El modelo de Bohr nos ayuda a visualizar cómo están organizados los electrones en el calcio y por qué este elemento es reactivo.
2. ¿Cuáles son las limitaciones del modelo de Bohr?
– Aunque es útil para átomos simples, no puede describir adecuadamente átomos más complejos debido a las interacciones entre electrones.
3. ¿Cómo se relaciona el modelo de Bohr con la espectroscopía?
– El modelo de Bohr explica cómo los electrones en un átomo emiten luz al saltar entre niveles de energía, lo que resulta en espectros atómicos únicos.
4. ¿Qué aplicaciones tiene el calcio en la vida diaria?
– El calcio es esencial para la salud ósea y dental, y también se utiliza en la construcción y la industria alimentaria.
5. ¿Qué otros modelos atómicos existen además del de Bohr?
– Existen modelos más avanzados, como el modelo cuántico, que abordan las limitaciones del modelo de Bohr y proporcionan una comprensión más completa de la estructura atómica.