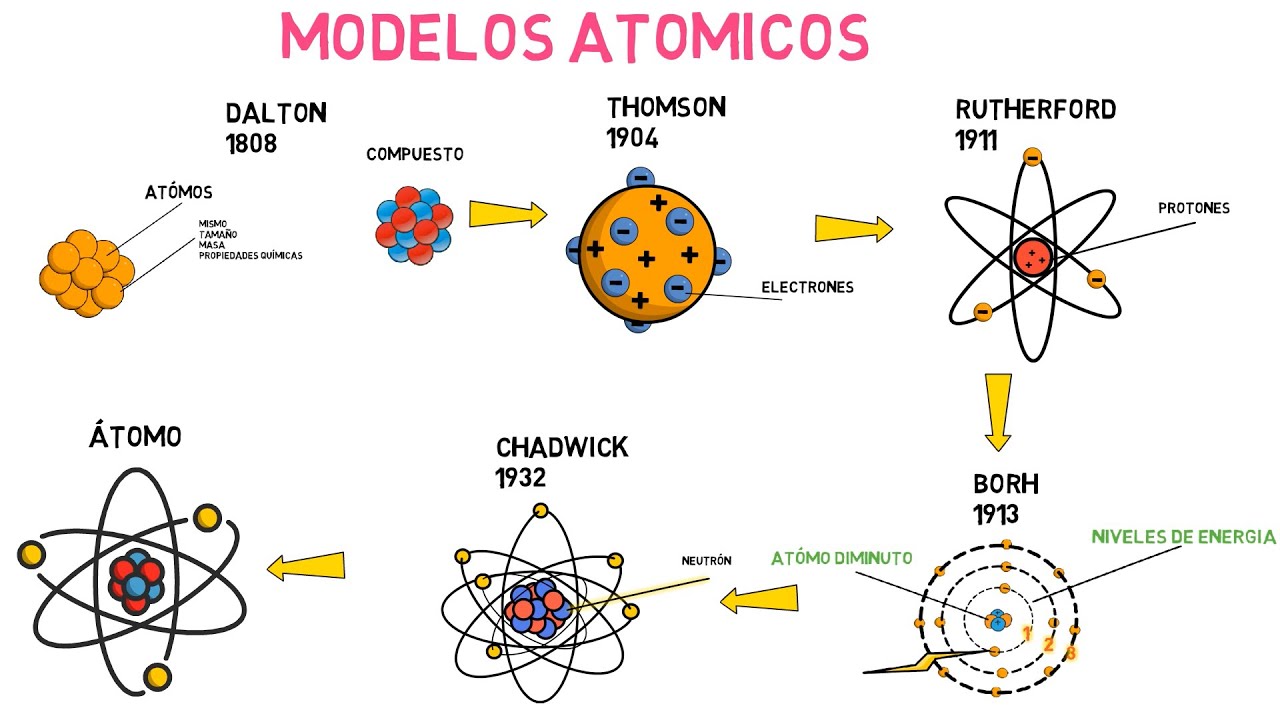
Descubre los 4 Modelos Atómicos: Dalton, Thomson, Rutherford y Bohr Explicados
Un Viaje a Través de la Historia de la Química
¡Hola! Hoy vamos a embarcarnos en un viaje fascinante por la historia de la química, explorando los modelos atómicos que han dado forma a nuestra comprensión del mundo a nivel microscópico. Imagina que el átomo es como un pequeño sistema solar, con sus propios planetas y estrellas. Cada modelo que vamos a discutir es como una versión diferente de este sistema solar, cada uno más complejo y detallado que el anterior. Desde la idea inicial de que los átomos son esferas indivisibles, hasta la imagen más intrincada de electrones orbitando alrededor de un núcleo denso, estos modelos reflejan el desarrollo del pensamiento científico a lo largo de los años. ¡Así que abróchate el cinturón y prepárate para un recorrido a través de la evolución del modelo atómico!
El Modelo Atómico de Dalton
Comencemos con John Dalton, un hombre que, a principios del siglo XIX, tenía una visión bastante radical de la materia. Imagina que Dalton se asoma a un microscopio y ve partículas diminutas. ¿Qué pensaría? Su modelo atómico, propuesto en 1803, sugiere que toda la materia está compuesta de átomos, que son indivisibles y que cada elemento está formado por átomos de un solo tipo. ¡Bum! Ahí lo tienes, una idea que cambió todo. Dalton pensaba que estos átomos eran como canicas en una bolsa, cada uno de un color diferente, representando diferentes elementos. Esta idea de los átomos como unidades discretas fue revolucionaria para su época.
Características del Modelo de Dalton
Dalton formuló varias leyes fundamentales que guiaron su teoría. Primero, la Ley de Conservación de la Masa, que establece que la masa no se crea ni se destruye en una reacción química. Luego está la Ley de Proporciones Definidas, que afirma que los compuestos siempre se forman a partir de los mismos elementos en proporciones fijas. Por último, la Ley de Proporciones Múltiples, que dice que si dos elementos pueden formar más de un compuesto, las masas de uno de los elementos que se combinan con una masa fija del otro se relacionan entre sí como números enteros simples. ¡Es un conjunto de reglas que parecen simples pero que abrieron la puerta a una nueva forma de ver la química!
El Modelo Atómico de Thomson
Avancemos un poco más en el tiempo, hasta 1897, cuando el físico J.J. Thomson descubrió el electrón. Imagínate la emoción en la sala cuando anunció que había encontrado una partícula más pequeña que el átomo. Su modelo atómico, conocido como el «modelo del pudín de ciruelas», imaginaba al átomo como una esfera cargada positivamente, con electrones incrustados en ella como si fueran ciruelas en un pudín. Esta imagen era muy diferente a la de Dalton, pero representaba un avance significativo en nuestra comprensión de la estructura atómica.
Implicaciones del Modelo de Thomson
El modelo de Thomson no solo introdujo el concepto de electrones, sino que también planteó preguntas interesantes sobre la estabilidad del átomo. Si los electrones son negativos y la esfera es positiva, ¿cómo se mantienen juntos? Aunque este modelo fue un gran paso adelante, pronto se hizo evidente que no podía explicar todos los fenómenos observados en la naturaleza, especialmente la forma en que los átomos interactúan entre sí. Pero no te preocupes, la historia no termina aquí.
El Modelo Atómico de Rutherford
Ahora, llegamos a Ernest Rutherford, quien en 1911 llevó la teoría atómica a un nuevo nivel. ¿Alguna vez has lanzado una pelota de tenis contra una pared y te has sorprendido al ver que rebota? Así es como Rutherford se sintió al realizar su famoso experimento de dispersión de partículas alfa. Al bombardear una delgada lámina de oro con estas partículas, descubrió que algunas de ellas rebotaban en direcciones inesperadas. ¿Qué significa esto? Que había algo denso y cargado positivamente en el átomo: el núcleo.
Características del Modelo de Rutherford
Rutherford propuso que el átomo está compuesto principalmente de espacio vacío, con electrones girando alrededor de un núcleo central denso, similar a cómo los planetas giran alrededor del sol. Esta fue una revelación asombrosa que cambió por completo la forma en que imaginábamos la estructura atómica. Sin embargo, el modelo de Rutherford también planteó nuevas preguntas: si los electrones se mueven en órbitas, ¿no deberían perder energía y caer en el núcleo? Esta pregunta llevó a la siguiente gran evolución en el modelo atómico.
El Modelo Atómico de Bohr
En 1913, Niels Bohr llegó al rescate con su modelo atómico, que combinó la teoría cuántica con el modelo de Rutherford. Bohr imaginó que los electrones orbitan el núcleo en niveles de energía específicos, como si fueran escalones en una escalera. ¿Recuerdas cuando te enseñaron que los electrones se comportan tanto como partículas como ondas? Bohr se apoyó en esta idea y sugirió que los electrones solo pueden ocupar ciertas órbitas estables. Cuando un electrón salta de un nivel a otro, absorbe o emite un fotón de luz, lo que explica por qué los átomos emiten o absorben luz en ciertas longitudes de onda.
La Revolución Cuántica y el Modelo de Bohr
El modelo de Bohr fue revolucionario porque introdujo la noción de cuantización en la estructura atómica. Imagina que cada nivel de energía es como un piso en un edificio: los electrones pueden estar en un piso específico, pero no pueden estar entre pisos. Este modelo explicó muchos fenómenos espectroscópicos y ayudó a establecer las bases de la mecánica cuántica. Sin embargo, como todos los modelos anteriores, el modelo de Bohr también tenía sus limitaciones y fue posteriormente refinado.
Conclusión: La Evolución Continua del Modelo Atómico
Así que ahí lo tienes: un recorrido por los cuatro modelos atómicos más importantes de la historia. Desde la idea básica de Dalton de que los átomos son esferas indivisibles, pasando por el «pudín de ciruelas» de Thomson, hasta el modelo nuclear de Rutherford y finalmente el modelo cuántico de Bohr. Cada uno de estos modelos ha contribuido a nuestra comprensión del átomo, y aunque algunos han sido superados, todos han jugado un papel crucial en el desarrollo de la química moderna.
Preguntas Frecuentes
¿Por qué el modelo de Dalton es importante hoy en día?
El modelo de Dalton es fundamental porque introdujo la idea de que la materia está compuesta por átomos, lo que sentó las bases para la química moderna. Sin su trabajo, no tendríamos la comprensión básica de los elementos y compuestos que tenemos hoy.
¿Qué limitaciones tiene el modelo de Thomson?
El modelo de Thomson no pudo explicar la estabilidad del átomo ni la disposición de los electrones en relación con el núcleo. Además, no contemplaba la existencia de un núcleo denso, lo que fue descubierto más tarde por Rutherford.
¿Cómo ha influido el modelo de Bohr en la ciencia moderna?
El modelo de Bohr fue crucial para el desarrollo de la mecánica cuántica. Introdujo la idea de niveles de energía cuantizados y ayudó a explicar el espectro de emisión de los átomos, lo que ha llevado a avances en campos como la química y la física atómica.
¿Por qué los modelos atómicos son solo modelos y no verdades absolutas?
Los modelos atómicos son representaciones simplificadas de la realidad. A medida que avanza la ciencia y se obtienen más datos, estos modelos son refinados o reemplazados por otros más precisos. La ciencia es un proceso en constante evolución.
¿Qué viene después en la teoría atómica?
La teoría cuántica sigue evolucionando, y los científicos continúan investigando la naturaleza de los electrones, los quarks y otros componentes subatómicos. Las teorías como la mecánica cuántica moderna y la teoría de cuerdas están explorando aún más las complejidades del universo atómico.