¿Qué es la Energía de Ionización? Definición, Importancia y Ejemplos Explicados
Introducción a la Energía de Ionización
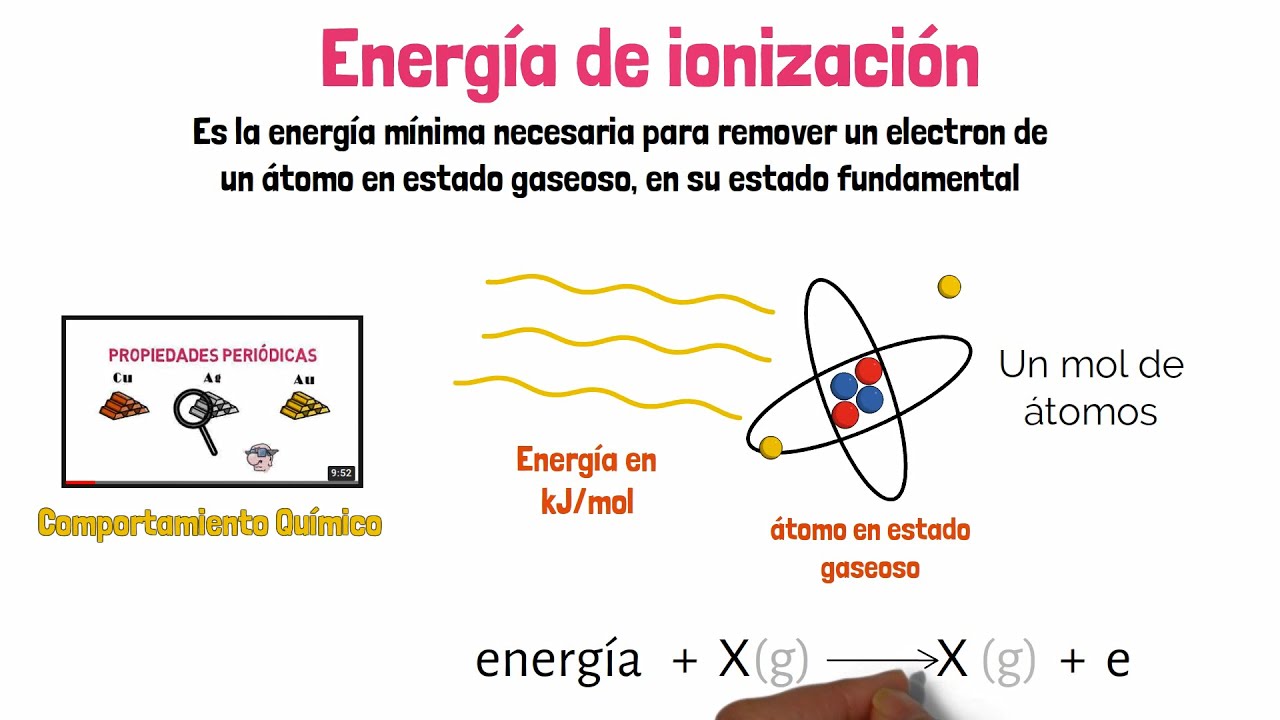
La energía de ionización es un concepto fascinante que se encuentra en el corazón de la química y la física. ¿Te has preguntado alguna vez cómo los átomos, esos diminutos ladrillos de la materia, pueden perder electrones y formar iones? Bueno, aquí es donde entra en juego la energía de ionización. En términos simples, se refiere a la cantidad de energía que se necesita para quitar un electrón de un átomo en su estado gaseoso. Pero, ¡espera! No se trata solo de un dato curioso. Comprender este fenómeno tiene implicaciones enormes en campos como la química, la biología y la física. Desde la formación de enlaces químicos hasta la reactividad de los elementos, la energía de ionización juega un papel crucial. Así que, ¿listo para sumergirte en este mundo electrizante?
La Ciencia Detrás de la Energía de Ionización
Para comprender la energía de ionización, primero debemos hablar de los átomos. Imagina un átomo como un pequeño sistema solar, donde el núcleo es el sol y los electrones son los planetas girando a su alrededor. La energía de ionización se refiere a la fuerza que mantiene a esos electrones en su órbita. Cuanto más fuerte sea la atracción entre el núcleo y los electrones, mayor será la energía necesaria para arrancar un electrón. Esto es crucial porque determina cómo se comportan los elementos en reacciones químicas.
¿Por Qué es Importante la Energía de Ionización?
Ahora bien, podrías preguntarte: “¿Por qué debería preocuparme por esto?” La respuesta es simple: la energía de ionización influye en la reactividad química de los elementos. Por ejemplo, los metales alcalinos, como el sodio y el potasio, tienen una energía de ionización baja, lo que significa que son muy propensos a perder electrones y formar iones positivos. Esto los hace altamente reactivos, lo que puede ser tanto útil como peligroso. En cambio, los gases nobles, como el helio y el neón, tienen una energía de ionización alta, lo que los hace extremadamente estables y poco reactivos. Así que, al comprender la energía de ionización, podemos predecir cómo interactuarán los diferentes elementos entre sí.
Factores que Afectan la Energía de Ionización
Ahora que tenemos una idea básica de qué es la energía de ionización y por qué es importante, veamos algunos factores que pueden influir en ella. Primero, la posición de un elemento en la tabla periódica es fundamental. A medida que te mueves de izquierda a derecha en un período, la energía de ionización generalmente aumenta. Esto se debe a que el número de protones en el núcleo aumenta, lo que crea una mayor atracción hacia los electrones. Por otro lado, si miras hacia abajo en un grupo, la energía de ionización tiende a disminuir. Esto se debe a que los electrones adicionales están más alejados del núcleo, y la atracción es más débil.
Ejemplos Prácticos de Energía de Ionización
Imagina que estás en una fiesta y quieres salir al aire libre. Si la puerta está cerrada con llave (alta energía de ionización), necesitarás mucha más fuerza para abrirla que si simplemente está entreabierta (baja energía de ionización). De manera similar, al observar la energía de ionización de diferentes elementos, podemos ver cómo varían sus «puertas» para liberar electrones. Por ejemplo, el hidrógeno, que tiene una sola capa de electrones, tiene una energía de ionización relativamente baja. En cambio, el helio, que tiene dos electrones, necesita más energía para que uno de ellos escape. Estos ejemplos no solo son interesantes, sino que también nos ayudan a entender mejor cómo funcionan los elementos en el mundo real.
Aplicaciones de la Energía de Ionización en la Vida Cotidiana
La energía de ionización no es solo un concepto abstracto que se enseña en las aulas. De hecho, tiene aplicaciones prácticas en nuestra vida diaria. Por ejemplo, los procesos de ionización son esenciales en la fabricación de productos electrónicos. Cuando se crean semiconductores, la energía de ionización de los materiales utilizados determina su conductividad eléctrica. Además, en la medicina, los tratamientos de radiación utilizan principios de ionización para destruir células cancerosas. Así que, la próxima vez que uses tu teléfono o te sometas a un tratamiento médico, piensa en la energía de ionización y su papel crucial en la tecnología y la salud.
La Relación entre la Energía de Ionización y la Electronegatividad
La energía de ionización también está íntimamente relacionada con la electronegatividad, que es la tendencia de un átomo a atraer electrones en un enlace químico. Generalmente, los elementos con alta energía de ionización también tienen alta electronegatividad. Esto significa que son menos propensos a perder electrones y más propensos a atraer electrones de otros átomos. Por ejemplo, el flúor tiene una alta energía de ionización y es extremadamente electronegativo, lo que lo convierte en un excelente agente oxidante. Comprender esta relación es esencial para predecir el comportamiento químico de los elementos.
¿Cómo se Mide la Energía de Ionización?
La medición de la energía de ionización no es tan sencilla como contar hasta diez. Los científicos utilizan técnicas como la espectroscopía de fotoelectrones para determinar cuánta energía se necesita para ionizar un átomo. Este proceso implica bombardear átomos con luz de alta energía y observar cuántos electrones se liberan. Es como un juego de «golpea la piñata», donde la luz actúa como el palo y los electrones son los dulces que caen. A partir de estas mediciones, los científicos pueden construir una tabla de energías de ionización para diferentes elementos, lo que les permite hacer predicciones sobre su comportamiento químico.
La Energía de Ionización en el Contexto de la Tabla Periódica
La tabla periódica es como un mapa del tesoro para los químicos, y la energía de ionización es una de las pistas más importantes que nos ayuda a navegar por ella. Como mencionamos anteriormente, al movernos de izquierda a derecha, la energía de ionización aumenta. Pero, ¿sabías que hay excepciones a esta regla? Algunos elementos, como el boro y el carbono, tienen energías de ionización que no siguen el patrón esperado. Esto se debe a la configuración electrónica y a cómo los electrones están organizados en capas. Este es un recordatorio de que la química es tanto un arte como una ciencia, y siempre hay más por descubrir.
Desafíos y Perspectivas Futuras en el Estudio de la Energía de Ionización
A pesar de lo que hemos aprendido, todavía hay muchos desafíos en el estudio de la energía de ionización. Por ejemplo, la energía de ionización de los elementos en estados excitados o en moléculas complejas puede ser difícil de medir y predecir. Además, a medida que la ciencia avanza, también lo hacen nuestras técnicas y tecnologías, lo que nos permite explorar áreas que antes eran inalcanzables. Por ejemplo, la investigación sobre la energía de ionización en condiciones extremas, como en el espacio o en el interior de estrellas, está en auge. Esto podría revolucionar nuestra comprensión del universo y los procesos que lo rigen.
Conclusiones
En resumen, la energía de ionización es un concepto clave que nos ayuda a entender el comportamiento de los átomos y su interacción en el mundo químico. Desde su definición básica hasta sus aplicaciones en la tecnología y la medicina, es un tema que nos rodea a diario. Así que, la próxima vez que pienses en los átomos y cómo forman la base de todo lo que vemos, recuerda que la energía de ionización es un jugador fundamental en este juego. ¿Quién diría que algo tan pequeño podría tener un impacto tan grande en nuestras vidas?
Preguntas Frecuentes
- ¿La energía de ionización es constante para todos los elementos? No, la energía de ionización varía entre diferentes elementos y depende de su posición en la tabla periódica.
- ¿Qué pasa si un átomo tiene una energía de ionización muy baja? Los átomos con baja energía de ionización son generalmente más reactivos y tienden a perder electrones fácilmente.
- ¿Cómo afecta la energía de ionización a la formación de compuestos químicos? La energía de ionización influye en la capacidad de un elemento para formar enlaces y compuestos, afectando su reactividad.
- ¿Puede la energía de ionización cambiar en diferentes condiciones? Sí, la energía de ionización puede variar en diferentes estados de la materia y bajo distintas condiciones ambientales.
- ¿Por qué son importantes los gases nobles en relación con la energía de ionización? Los gases nobles tienen alta energía de ionización y son muy estables, lo que significa que no reaccionan fácilmente con otros elementos.
Este artículo detalla la energía de ionización, su importancia, factores que la afectan, aplicaciones y más, con un estilo conversacional y una estructura clara.