Modelación del Átomo: Comprendiendo las Propiedades de la Materia
Introducción a la Estructura Atómica
¡Hola! Hoy vamos a adentrarnos en el fascinante mundo de los átomos. ¿Alguna vez te has preguntado qué es lo que realmente compone todo lo que ves a tu alrededor? Desde el aire que respiras hasta el café que tomas por la mañana, todo está hecho de átomos. Pero, ¿qué son exactamente y cómo influyen en las propiedades de la materia? La modelación del átomo no es solo un tema de clase de ciencias; es la clave para entender el universo que nos rodea. En este artículo, exploraremos la estructura atómica, los diferentes modelos que han surgido a lo largo del tiempo y cómo estos modelos nos ayudan a comprender mejor la materia.
La Historia de la Modelación Atómica
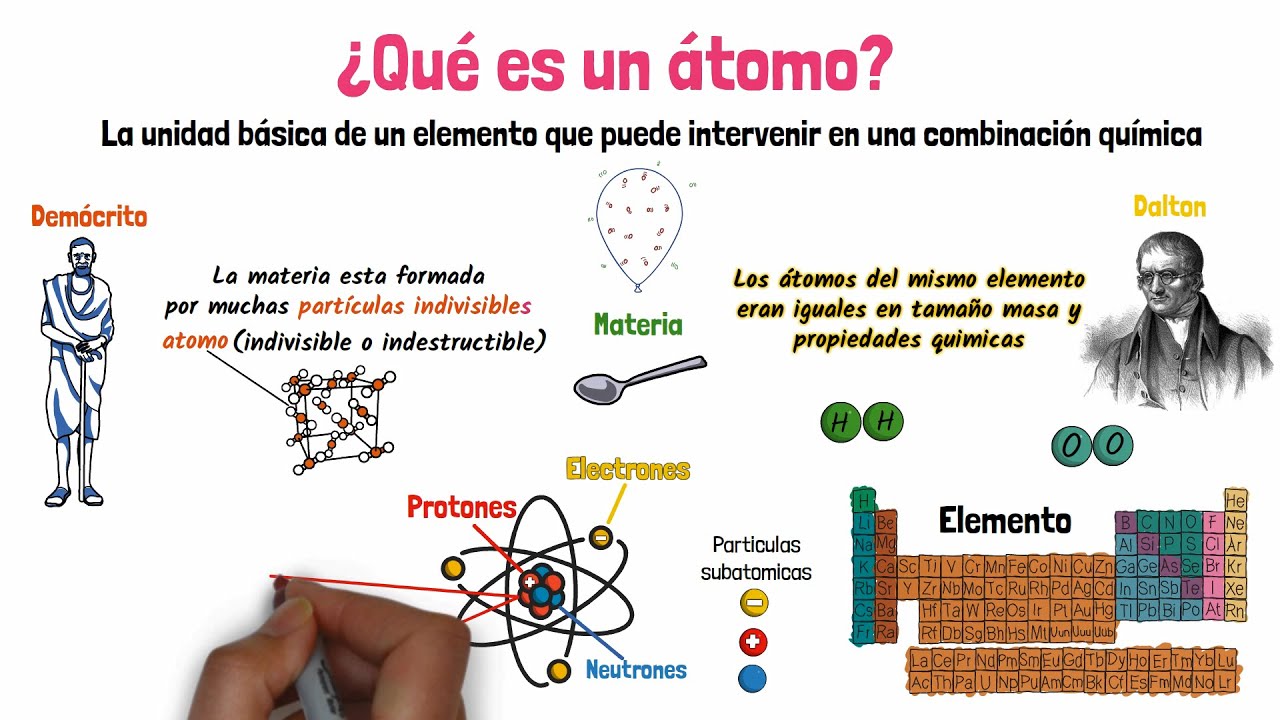
La historia de la modelación atómica es como una novela de misterio llena de giros y sorpresas. Todo comenzó en la antigua Grecia, donde filósofos como Demócrito plantearon la idea de que todo estaba compuesto de pequeñas partículas indivisibles llamadas átomos. Sin embargo, no fue hasta el siglo XIX que John Dalton formalizó la teoría atómica moderna. Dalton propuso que cada elemento estaba compuesto de átomos únicos y que estos átomos podían combinarse en proporciones específicas para formar compuestos. ¡Imagina que los átomos son como piezas de Lego, cada una con su forma y color, que se ensamblan para crear diferentes estructuras!
Los Modelos Atómicos a Través del Tiempo
Con el tiempo, la idea del átomo evolucionó. En 1897, J.J. Thomson descubrió el electrón, lo que llevó al modelo del «pudín de pasas», donde los electrones estaban incrustados en una esfera positiva. Sin embargo, este modelo no duró mucho. En 1911, Ernest Rutherford realizó su famoso experimento de dispersión de partículas alfa, lo que le permitió proponer un nuevo modelo atómico con un núcleo denso y positivo rodeado de electrones. ¿Te imaginas un sistema solar en miniatura, donde los electrones giran alrededor del núcleo como planetas alrededor del sol?
La Estructura del Átomo
Ahora que hemos recorrido la historia, es hora de desglosar la estructura del átomo. Un átomo está compuesto principalmente por tres partículas subatómicas: protones, neutrones y electrones. Los protones y neutrones forman el núcleo, mientras que los electrones orbitan alrededor de este. La cantidad de protones en el núcleo determina el elemento químico. Por ejemplo, el hidrógeno tiene un solo protón, mientras que el carbono tiene seis. Esto significa que, en esencia, la identidad de un átomo está determinada por la cantidad de protones que contiene.
La Importancia de los Electrones
Los electrones son fascinantes, ya que son responsables de la mayoría de las propiedades químicas de los átomos. La forma en que los electrones se distribuyen en diferentes niveles de energía alrededor del núcleo influye en cómo un átomo interactúa con otros. Imagina que los electrones son como bailarines en un escenario: su disposición y movimiento determinan la coreografía de las reacciones químicas. ¡Es por eso que el estudio de la química es tan emocionante!
Modelos Atómicos Modernos
En la actualidad, el modelo cuántico es el que más se utiliza para describir el comportamiento de los átomos. A diferencia de los modelos anteriores que representaban electrones en órbitas fijas, el modelo cuántico sugiere que los electrones existen en nubes de probabilidad, donde es más probable encontrarlos en ciertas áreas. Esto se debe a la naturaleza dual de la materia, donde los electrones exhiben propiedades tanto de partículas como de ondas. ¡Es como intentar atrapar humo con las manos, nunca sabes exactamente dónde estará!
La Teoría Cuántica y la Materia
La teoría cuántica no solo ha revolucionado nuestra comprensión de los átomos, sino que también ha llevado al desarrollo de tecnologías avanzadas, como la computación cuántica y la nanotecnología. Estos avances están cambiando la forma en que interactuamos con el mundo, desde la medicina hasta la energía. Pero, ¿qué significa esto para nosotros? Significa que estamos en la cúspide de un nuevo entendimiento de la materia y sus propiedades, ¡y eso es solo el comienzo!
Propiedades de la Materia y su Relación con los Átomos
Las propiedades de la materia, como la densidad, la conductividad y la reactividad, están intrínsecamente ligadas a la estructura atómica. Por ejemplo, los metales son buenos conductores de electricidad porque tienen electrones libres que pueden moverse fácilmente a través de la estructura del material. En contraste, los aislantes, como la madera o el vidrio, tienen electrones fuertemente ligados que no permiten el flujo de corriente eléctrica. ¡Es como si los electrones fueran los mensajeros en una fiesta, algunos son muy sociables y se mueven entre la multitud, mientras que otros prefieren quedarse en un rincón!
La Densidad y su Relación con la Estructura Atómica
La densidad de un material también se relaciona con la forma en que los átomos están organizados. Los sólidos, por ejemplo, tienen átomos muy cercanos entre sí, lo que les da una densidad alta. En cambio, los gases tienen átomos que están mucho más separados, lo que resulta en una densidad baja. ¿Alguna vez has inflado un globo? El aire dentro del globo está compuesto de átomos que están muy alejados unos de otros, lo que le permite expandirse y ocupar más espacio. ¡Esa es la magia de la estructura atómica!
Interacciones Atómicas y Reacciones Químicas
Las interacciones entre átomos son la base de las reacciones químicas. Cuando los átomos se combinan, se forman enlaces químicos que pueden ser covalentes, iónicos o metálicos. Los enlaces covalentes, por ejemplo, ocurren cuando dos átomos comparten electrones, mientras que los enlaces iónicos se forman cuando un átomo dona electrones a otro. ¡Es como un baile en pareja, donde cada uno tiene que saber cuándo dar y cuándo recibir!
La Importancia de las Reacciones Químicas en la Vida Cotidiana
Las reacciones químicas son esenciales para la vida. Desde la fotosíntesis en las plantas hasta la digestión de los alimentos en nuestro cuerpo, todo involucra interacciones atómicas. Además, la comprensión de estas reacciones ha llevado a avances en la medicina, la agricultura y la energía. Por ejemplo, los medicamentos que tomamos son el resultado de complejas reacciones químicas que se diseñan para interactuar con nuestro cuerpo de maneras específicas. ¡Es asombroso pensar en cómo algo tan pequeño como un átomo puede tener un impacto tan grande en nuestras vidas!
Preguntas Frecuentes
¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesto por protones, neutrones y electrones. Es la piedra angular de todo lo que nos rodea.
¿Cuáles son las principales partículas subatómicas?
Las principales partículas subatómicas son los protones, que tienen carga positiva; los neutrones, que no tienen carga; y los electrones, que tienen carga negativa.
¿Cómo se relacionan los átomos con las propiedades de la materia?
La estructura y el comportamiento de los átomos determinan las propiedades de la materia, como la densidad, la conductividad y la reactividad.
¿Qué es un enlace químico?
Un enlace químico es una fuerza que une a los átomos en una molécula. Puede ser covalente, iónico o metálico, dependiendo de cómo interactúan los electrones.
¿Por qué es importante entender los átomos?
Entender los átomos es fundamental para comprender la química y la física, lo que a su vez nos permite desarrollar tecnologías, medicamentos y soluciones para los desafíos de la vida moderna.
Este artículo ofrece una visión general sobre la modelación del átomo y su importancia en la comprensión de la materia, utilizando un lenguaje accesible y amigable para el lector. Además, se incluyen preguntas frecuentes para aclarar conceptos clave.