Todo lo que Debes Saber sobre la Ley de las Proporciones Constantes: Definición y Ejemplos
Introducción a la Ley de las Proporciones Constantes
La Ley de las Proporciones Constantes es uno de esos conceptos en química que, aunque puede parecer un poco árido al principio, es fundamental para entender cómo se comportan los compuestos químicos. ¿Te has preguntado alguna vez por qué el agua siempre tiene la misma composición, sin importar de dónde provenga? Esto es precisamente lo que aborda esta ley: la idea de que un compuesto químico siempre está formado por los mismos elementos en proporciones fijas. Así que, si estás listo para zambullirte en el fascinante mundo de la química, ¡vamos a ello!
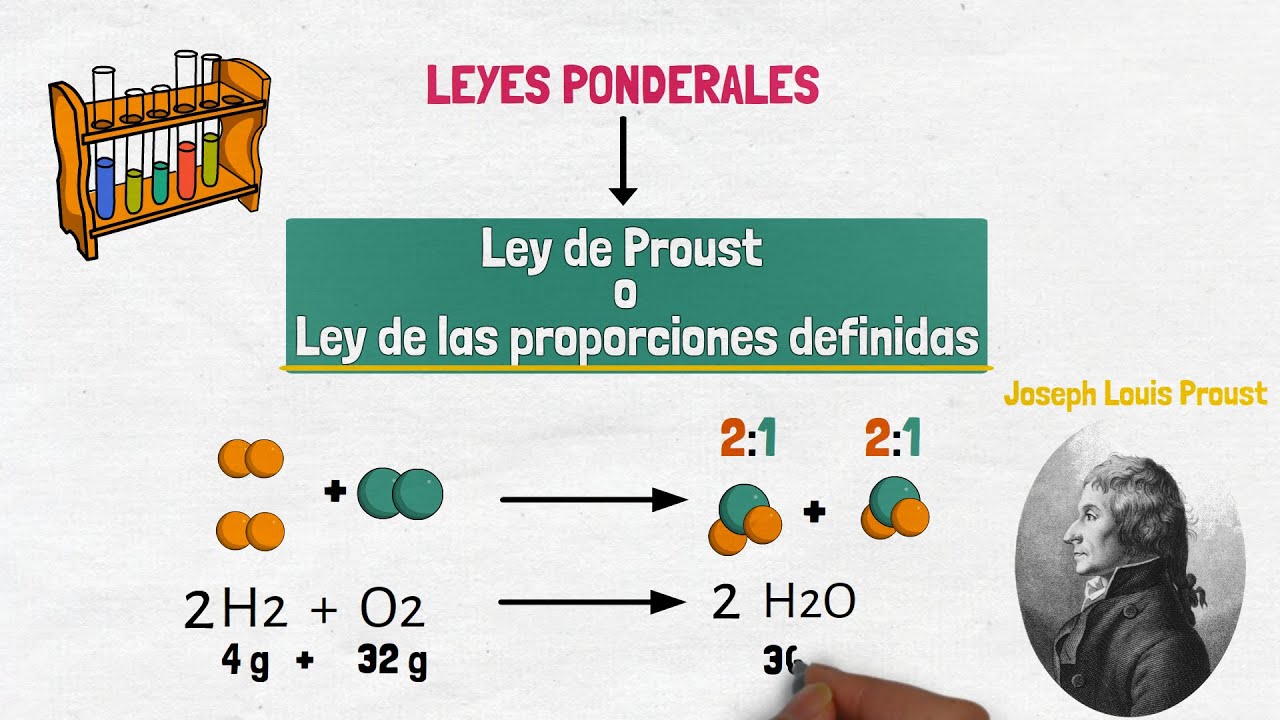
Para empezar, vamos a definir qué es exactamente la Ley de las Proporciones Constantes. En términos simples, esta ley establece que cuando un compuesto se forma, siempre lo hace con la misma proporción de elementos, sin importar la fuente de esos elementos. Por ejemplo, el agua (H₂O) siempre estará compuesta por dos átomos de hidrógeno y uno de oxígeno. ¡No importa si proviene de un río, de un grifo o de un deshielo! Esta idea fue establecida por el químico francés Joseph Proust en el siglo XVIII y ha sido una piedra angular en el estudio de la química desde entonces.
La Importancia de la Ley de las Proporciones Constantes
La Ley de las Proporciones Constantes no solo es un principio teórico; tiene implicaciones prácticas que afectan nuestra vida diaria. ¿Te imaginas un mundo en el que el agua no siempre tuviera la misma composición? Sería un verdadero caos, ¿verdad? Este principio nos asegura que los productos químicos son predecibles y fiables, lo que es crucial para todo, desde la fabricación de medicamentos hasta la producción de alimentos.
Además, esta ley permite a los científicos realizar experimentos y predicciones precisas. Si sabemos que un compuesto siempre tendrá una composición específica, podemos predecir cómo reaccionará en diferentes circunstancias. Esto es especialmente útil en campos como la farmacología, donde la precisión en la composición de los medicamentos puede significar la diferencia entre la cura y el efecto adverso.
Ejemplos Prácticos de la Ley de las Proporciones Constantes
Para ilustrar mejor este concepto, veamos algunos ejemplos prácticos. Como ya mencionamos, el agua es un ejemplo clásico. Pero hay más. Pensemos en el dióxido de carbono (CO₂). Este gas está compuesto por un átomo de carbono y dos átomos de oxígeno. No importa cómo se produzca el CO₂, ya sea por la combustión de un combustible fósil o por la respiración de un ser humano, siempre tendrá esa misma proporción de elementos. ¡Es como una receta que nunca cambia!
Otro ejemplo es el cloruro de sodio, más conocido como sal de mesa. Este compuesto está formado por un átomo de sodio y un átomo de cloro. Siempre que encuentres sal, ya sea en la cocina de tu casa o en un restaurante, puedes estar seguro de que tendrá esa misma composición. Esta constancia en la proporción de los elementos es lo que permite que los químicos trabajen con confianza en sus experimentos.
¿Cómo se Relaciona la Ley de las Proporciones Constantes con Otras Leyes de la Química?
La Ley de las Proporciones Constantes no opera en un vacío; se relaciona con otras leyes químicas que también son fundamentales para entender el comportamiento de la materia. Una de estas leyes es la Ley de la Conservación de la Masa, que establece que la masa total de los reactivos en una reacción química siempre será igual a la masa total de los productos. Esto significa que los átomos no se crean ni se destruyen, sino que se reorganizan. Juntas, estas leyes proporcionan un marco coherente para entender las reacciones químicas.
Otra ley que se relaciona es la Ley de las Proporciones Múltiples. Esta ley se refiere a situaciones en las que dos elementos pueden formar más de un compuesto entre sí. En este caso, las proporciones de los elementos en los compuestos estarán en una relación de números enteros simples. Por ejemplo, el óxido de carbono (CO) y el dióxido de carbono (CO₂) son dos compuestos formados por carbono y oxígeno, pero en diferentes proporciones. Este tipo de relaciones también es crucial para la comprensión de la química.
Aplicaciones de la Ley de las Proporciones Constantes en la Vida Cotidiana
Las aplicaciones de la Ley de las Proporciones Constantes son omnipresentes en nuestra vida diaria. Desde el agua que bebemos hasta los alimentos que consumimos, esta ley juega un papel esencial en la seguridad y la calidad de lo que nos rodea. Por ejemplo, en la industria alimentaria, la composición química de los ingredientes debe ser constante para garantizar que los productos sean seguros y de alta calidad.
Además, en el campo de la medicina, la Ley de las Proporciones Constantes es vital para la formulación de medicamentos. Los farmacéuticos deben asegurarse de que cada comprimido o inyección contenga la cantidad exacta de cada compuesto para que sea eficaz y seguro para el paciente. Así que, la próxima vez que tomes un medicamento, recuerda que detrás de esa pastilla hay una ciencia precisa que asegura que funcionará como se espera.
Desmitificando la Ley de las Proporciones Constantes
A veces, los términos científicos pueden parecer intimidantes, pero desmitificar la Ley de las Proporciones Constantes es más sencillo de lo que parece. Piensa en esta ley como una receta de cocina. Cada ingrediente debe estar en la cantidad justa para que el plato final sea delicioso. Si agregas más o menos de un ingrediente, el resultado final puede no ser el esperado. De la misma manera, en la química, si los elementos no están en las proporciones correctas, el compuesto resultante puede ser completamente diferente.
Por ejemplo, imagina que estás preparando un batido de frutas. Si decides añadir más plátano que fresa, el sabor cambiará drásticamente. En química, esto es lo que sucede si alteras las proporciones de los elementos en un compuesto. La consistencia y la previsibilidad son clave, y la Ley de las Proporciones Constantes nos ayuda a mantener esas características.
La Relevancia de la Ley en la Educación Química
En el ámbito educativo, la Ley de las Proporciones Constantes es un tema central en los cursos de química. Ayuda a los estudiantes a comprender cómo se forman los compuestos y por qué ciertas reacciones ocurren de la manera en que lo hacen. Al aprender sobre esta ley, los estudiantes desarrollan un sentido más profundo de la química y comienzan a ver las conexiones entre los diferentes conceptos químicos.
Además, la comprensión de esta ley puede inspirar a los estudiantes a explorar carreras en ciencias, ingeniería y medicina. La química está en el corazón de muchas disciplinas científicas, y una base sólida en los principios químicos es esencial para el éxito en estos campos.
Conclusiones y Reflexiones Finales
En resumen, la Ley de las Proporciones Constantes es un concepto fundamental en la química que nos asegura que los compuestos se forman de manera predecible y constante. Desde el agua que bebemos hasta los medicamentos que tomamos, esta ley tiene un impacto significativo en nuestra vida diaria. Al comprender esta ley, no solo apreciamos más la química, sino que también podemos ver cómo afecta todo a nuestro alrededor.
¿Te has sorprendido al descubrir cómo una simple ley puede tener tantas implicaciones en tu vida cotidiana? La química está llena de sorpresas y descubrimientos, y la Ley de las Proporciones Constantes es solo el comienzo. Así que, la próxima vez que te encuentres con un compuesto químico, recuerda: hay una historia detrás de cada fórmula y una razón por la que cada elemento está allí en la proporción exacta.
Preguntas Frecuentes
¿Qué sucede si se altera la proporción de los elementos en un compuesto?
Alterar la proporción de los elementos puede resultar en un compuesto completamente diferente, que puede tener propiedades físicas y químicas distintas. Por ejemplo, el agua (H₂O) es muy diferente del peróxido de hidrógeno (H₂O₂), que es tóxico.
¿La Ley de las Proporciones Constantes se aplica a todos los compuestos?
Sí, la Ley de las Proporciones Constantes se aplica a todos los compuestos químicos, siempre que estén formados por los mismos elementos en proporciones fijas.
¿Cómo se relaciona la Ley de las Proporciones Constantes con la Ley de la Conservación de la Masa?
Ambas leyes son fundamentales en la química. La Ley de las Proporciones Constantes se centra en la composición de los compuestos, mientras que la Ley de la Conservación de la Masa establece que la masa total de los reactivos siempre es igual a la masa total de los productos en una reacción química.
¿Por qué es importante la Ley de las Proporciones Constantes en la industria alimentaria?
Es importante porque garantiza que los productos alimenticios tengan una composición constante y segura, lo que es crucial para la salud y la calidad de los alimentos que consumimos.
¿Cómo se aplica la Ley de las Proporciones Constantes en la farmacología?
En farmacología, esta ley asegura que cada medicamento contenga la cantidad exacta de cada compuesto necesario para su eficacia y seguridad, lo que es vital para la salud de los pacientes.