La Evolución de los Modelos Atómicos: Un Viaje a Través de la Historia de la Ciencia
Un Breve Resumen de los Modelos Atómicos
¿Alguna vez te has preguntado cómo llegamos a comprender la estructura del átomo? La historia de los modelos atómicos es como una novela fascinante que se desarrolla a lo largo de los siglos, llena de descubrimientos sorprendentes y giros inesperados. Desde la antigua Grecia hasta nuestros días, los científicos han tratado de desentrañar el misterio de la materia y su composición. Vamos a explorar juntos este viaje, donde cada modelo atómico ha sido una pieza clave en el rompecabezas del conocimiento humano.
### La Antigua Grecia: La Semilla del Conocimiento
En la antigüedad, filósofos como Demócrito y Leucipo fueron pioneros en la idea de que la materia estaba compuesta por partículas indivisibles, a las que llamaron «átomos». Imagínate, en un mundo lleno de mitos y dioses, estos pensadores se atrevieron a sugerir que todo lo que nos rodea está hecho de pequeñas «bolitas» que no se pueden ver. Aunque sus ideas no fueron aceptadas en su momento, sentaron las bases para futuros estudios. ¿No es increíble pensar que hace más de dos mil años ya había mentes cuestionando la naturaleza de la materia?
### El Renacimiento y el Nacimiento de la Química
Con el Renacimiento, la ciencia comenzó a tomar un rumbo más experimental. En el siglo XVII, figuras como Robert Boyle empezaron a desafiar las ideas tradicionales sobre la materia. Boyle, conocido como el padre de la química moderna, propuso que los elementos eran sustancias puras y que podían combinarse para formar compuestos. Aquí es donde la ciencia se convierte en algo más tangible, un laboratorio lleno de frascos y experimentos. ¿Te imaginas estar allí, viendo cómo los primeros químicos empezaban a descubrir los secretos de la naturaleza?
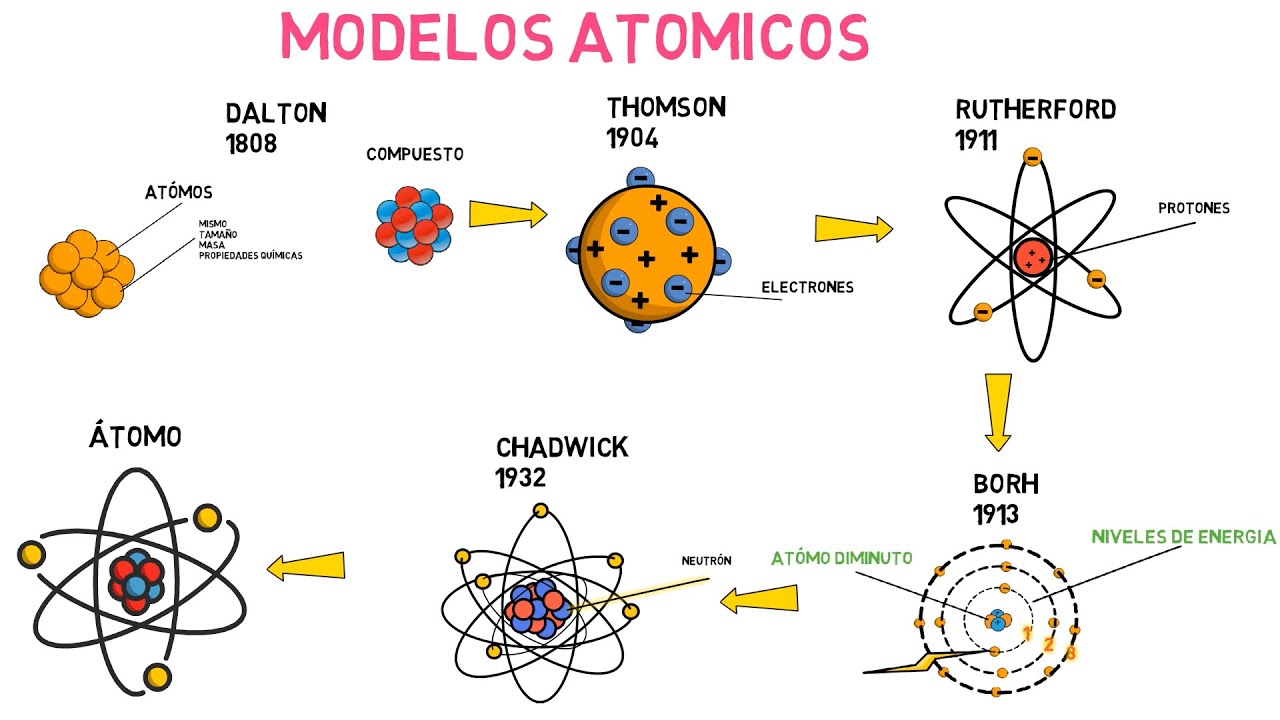
### Dalton y la Teoría Atómica
A principios del siglo XIX, John Dalton dio un gran paso al formalizar la teoría atómica. Propuso que cada elemento está compuesto por átomos de un solo tipo y que estos átomos se combinan en proporciones fijas para formar compuestos. Su enfoque era como un rompecabezas, donde cada pieza tenía que encajar de manera precisa. Esta idea revolucionó la química, proporcionando un marco para entender las reacciones químicas. Pero, ¿realmente pensaba que los átomos eran esferas sólidas e indivisibles? ¡Así es! Su modelo fue una gran simplificación, pero una simplificación necesaria para avanzar.
### Thomson y el Descubrimiento del Electrón
La historia se torna aún más emocionante con J.J. Thomson y su descubrimiento del electrón en 1897. Al utilizar un tubo de rayos catódicos, demostró que los átomos no eran indivisibles, como había propuesto Dalton. ¡Los átomos tenían partes más pequeñas! Thomson presentó su modelo de «pudín de pasas», donde los electrones estaban incrustados en una esfera positiva. Imagina una bola de masa con chispas de chocolate: la masa representa la carga positiva y las chispas los electrones. Este fue un cambio radical en la forma en que entendíamos la estructura atómica. ¿Quién diría que la materia podía ser tan compleja?
### Rutherford y el Núcleo Atómico
Apenas una década después, Ernest Rutherford llevó las cosas un paso más allá. A través de su famoso experimento de dispersión de partículas alfa, demostró que el átomo tenía un núcleo central, denso y cargado positivamente, rodeado por electrones en órbita. Este modelo, que se asemeja más a un sistema solar, fue una revelación. Rutherford se dio cuenta de que la mayor parte del átomo es espacio vacío, lo que nos hace cuestionar cómo es posible que los objetos sean tan sólidos. ¿Te imaginas un átomo como un pequeño sistema solar, donde los electrones giran alrededor de un núcleo como planetas alrededor del sol? Es una imagen fascinante.
### Bohr y la Cuantización de la Energía
Luego llegó Niels Bohr en 1913, quien combinó la teoría cuántica con el modelo de Rutherford. Propuso que los electrones orbitan el núcleo en niveles de energía específicos, como peldaños en una escalera. Esto significaba que los electrones podían saltar de un nivel a otro, pero no podían estar en un lugar intermedio. Esta idea de cuantización fue un gran avance, ya que explicó por qué los átomos emiten o absorben luz en ciertas longitudes de onda. ¿Alguna vez te has preguntado por qué los fuegos artificiales tienen diferentes colores? Bohr lo explicó a través de su modelo, donde cada color corresponde a un salto de energía de un electrón.
### La Mecánica Cuántica y el Modelo Cuántico
Con el avance de la física cuántica en el siglo XX, los modelos atómicos comenzaron a cambiar nuevamente. La mecánica cuántica nos enseñó que no se puede conocer la posición exacta de un electrón; en su lugar, se habla de «nubes de probabilidad» donde es más probable encontrarlo. Este nuevo enfoque fue un giro radical en nuestra comprensión de la materia. Ya no era solo un modelo de peldaños, sino más bien una danza compleja donde los electrones se mueven en patrones impredecibles. ¿No es alucinante pensar que, en un nivel fundamental, la materia es más una probabilidad que una certeza?
### El Modelo Estándar de la Física de Partículas
Hoy en día, el modelo estándar de la física de partículas nos proporciona un marco para entender no solo los átomos, sino también las partículas subatómicas que los componen: quarks, leptones y bosones. Esta teoría ha sido confirmada por numerosos experimentos, incluyendo los realizados en el Gran Colisionador de Hadrones. La ciencia sigue avanzando, y cada descubrimiento nos acerca un poco más a entender los misterios del universo. ¿Quién sabe qué nos deparará el futuro? Tal vez estemos al borde de descubrir nuevas partículas o incluso dimensiones desconocidas.
### Conclusiones: Un Viaje Infinito
La evolución de los modelos atómicos es un testimonio del ingenio humano y de nuestra curiosidad innata. Desde las ideas filosóficas de los antiguos griegos hasta las complejidades de la mecánica cuántica, cada paso en este viaje ha sido crucial para expandir nuestro conocimiento. Es asombroso pensar en cómo la ciencia ha cambiado nuestra percepción del mundo. Pero este viaje no ha terminado; siempre hay más por descubrir. ¿Qué nuevos modelos y teorías surgirán en el futuro? Solo el tiempo lo dirá.
### Preguntas Frecuentes
1. ¿Por qué es importante la teoría atómica?
La teoría atómica es fundamental porque nos ayuda a entender la composición de la materia y cómo interactúan los elementos entre sí. Sin ella, no podríamos explicar fenómenos químicos ni físicos.
2. ¿Cuál fue el primer modelo atómico?
El primer modelo atómico reconocido fue el de John Dalton, quien propuso que los átomos eran esferas sólidas e indivisibles.
3. ¿Qué descubrimiento hizo J.J. Thomson?
J.J. Thomson descubrió el electrón, lo que llevó a la comprensión de que los átomos tienen partes más pequeñas.
4. ¿Qué es el modelo de Bohr?
El modelo de Bohr propone que los electrones orbitan el núcleo en niveles de energía específicos, similar a cómo los planetas orbitan alrededor del sol.
5. ¿Cómo ha cambiado nuestra comprensión de los átomos con la mecánica cuántica?
La mecánica cuántica nos ha enseñado que no podemos conocer la posición exacta de un electrón, sino que debemos pensar en términos de probabilidades y nubes de electrones.
¡Espero que hayas disfrutado de este recorrido por la historia de los modelos atómicos! ¿Tienes más preguntas sobre este fascinante tema?